









Категория: Инструкции
Информация размещенная на данной странице носит ознакомительный характер и не может использоваться при самолечении!
Перед применением препаратов ОБЯЗАТЕЛЬНО необходима консультация со специалистом!
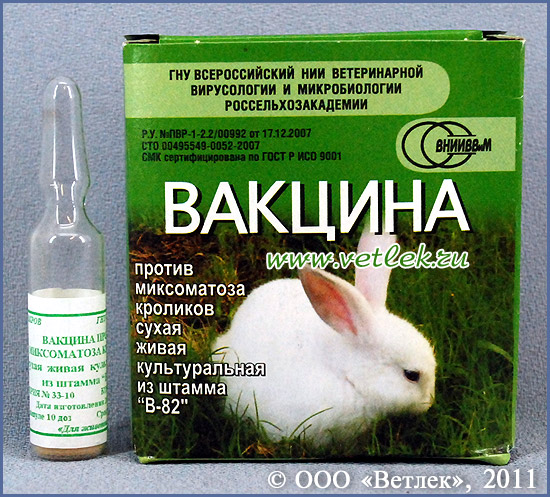
Краткое описание: вакцину производят специально для кроликов из вируса миксомы (его штамма «В-82»), лишенного способности заражать животный организм, и особой защитной среды. Вакцина абсолютно безвредна для кроликов и при внутрикожном, и при внутримышечном введении. Она предназначена для формирования у вакцинированных животных эффективного длительного (до 9 месяцев) иммунитета против миксоматоза. Становление иммунной защиты происходит в течение 9 дней с момента вакцинации.
Для кого: вакцину применяют для иммунизации здоровых кроликов с целью профилактики миксоматоза. Делают это как в угрожаемых и неблагополучных по данному заболеванию районах, так и в благополучных.
Форма отпуска: вакцина (пористая сухая субстанция бело-желтого цвета) поступает к потребителю расфасованной с соблюдением стерильности в стеклянные ампулы (по 0,5–2 куб. см) и в стеклянные флаконы (по 1–5 куб. см). Вместимость ампулы или флакона больше объема сухой вакцины, так как ее разводят растворителем. Все флаконы и ампулы имеют маркировку с подробнейшей информацией о производителе и самом ветеринарном средстве, количестве доз вакцины. Стеклянная тара упакована в коробки из картона.
Дозировка: иммунизировать кроликов начинают, когда им исполняется 4 недели, а через три месяца проводят ревакцинацию. Время года и эпизоотическая ситуация значения не имеют, но лучшим временем для прививок считается весна. Беременные крольчихи тоже подлежат вакцинации.
В качестве растворителя можно брать физиологический раствор или дистиллированную воду. В инструкции, которая прилагается к каждой товарной единице, подробнейшим образом расписано, как и в каких пропорциях разводить вакцину, куда и как ее вводить. Эта информация предназначена исключительно для ветеринарных врачей.
Ограничения: приобретенную вакцину нужно использовать в течение 12 месяцев со дня ее изготовления.
Отзывы про «Вакцина от миксоматоза кроликов »:Правила вакцинирования, рекомендации ветеринарных врачей, вакцины, отзывы.
Вакцинация представляет собой наиболее оптимальный способ устранения возможности заражения кроликов различными инфекционными заболеваниями. Наиболее часто кролики болеют вирусной геморрагической болезнью (ВГБК) и миксоматозом. Болезни неизлечимы и в 99% из 100% приводят к гибели животного, следовательно, проводить профилактическую вакцинацию необходимо в обязательном порядке.
Как лучше всего проводить вакцинацию
Вакцинация кроликов проводится практически безболезненно для животного. Но перед проведением процедуры необходимо убедиться в том, что кролик абсолютно здоров, в противном случае возрастает риск, что животное может погибнуть.
Кролик, который привит вакциной, сохраняет стойкий иммунитет к инфекционным возбудителям на протяжении 6 и даже 9 месяцев, но все зависит от индивидуального строения организма и реакции на определенную марку вакцины. Еще одно условие, которое необходимо выполнить перед проведением вакцинации, — это профилактика глистов. Для этих целей существует целый ряд препаратов, которые способны эффективно и быстро вылечить грызуна, при этом не причинить ему никакого вреда. К таким препаратам можно отнести «Дирофен-паста», а также «Паразицид-суспензия», которая имеет сладковатый привкус.
Наиболее оптимальным возрастом для осуществления прививки является 6-7 недель, так как в этот период животное легко сможет перенести процедуру. Вес кролика на момент вакцины не должен быть меньше, чем 500 грамм. Крайне нежелательно проводить вакцинацию крольчихи, которая находится в периоде беременности или кормления.
Отдельно необходимо отметить проведение вакцинации особей, которых готовят к конкурсам и выставкам. Прививка делается в период от 2 до 4 недель от даты, на которую назначено мероприятие. Вакцинировать животное можно только в государственной клинике, так как дату прививки и марку вакцины необходимо внести в паспорт, который заводится на кролика. Фото процесса вакцинации:
вакцинация кроликов
Что делать после прививания
Кролика, которого вакцинировали, необходимо держать в строгом карантине на протяжении 14 дней. Делается это для того, чтобы привитое животное не смогло заразиться от больного кролика, с которым обычно находится в одной клетке. По истечению указанного срока вакцина полностью активируется, и риск заражения сводится к нулю. В отношении кормления животного особых предписаний нет, следовательно, рацион питания не меняется после проведения вакцинации. Единственное,
что необходимо обеспечить для животного — это открытый доступ к воде.
Что касается побочных действий после прививки, то чаще всего у животного проявляется обильное слюноотделение, которое связано с индивидуальной чувствительностью к компонентам препарата. Если проявляются побочные эффекты, дополнительное лечение не назначается, так как симптомы проходят сами собой через несколько дней.
Схемы вакцинации и расписание прививок
Четкое следование выбранной схемы вакцинации кролика – это половина успеха от проведения процедуры. Современные технологии привели к тому, что вакцинация животного проводится безболезненно и достаточно быстро. В России и в соседних странах наиболее популярны две схемы привития кроликов от инфекционных заболеваний.
Схема № 1. Вакцинация животного общая.
Первую прививку проводят в возрасте 45-ти дней жизни; вторая прививка осуществляется через 3 месяца (не меньше, так как в этот период происходит закрепление иммунитета на заболевание); ревакцинация проводится каждые 5-6 месяцев на протяжении всей жизни.
Схема № 2. Вакцинация животного от вирусной геморрагической болезни (ВГБК) и миксоматоза.
1.Первая прививка (от ВГБК) – в возрасте 45 дней;
2.Вторая прививка (от миксоматоза) – по истечению двух недель;
3.Третья прививка (от миксоматоза) – через 3 месяца;
4.Четвертая прививка (от ВГБК) – по истечению 2 недель;
В дальнейшем прививки проводить каждые 6 месяцев, чередуя вакцины против заболеваний с выдержкой промежутка времени, не менее чем 2 недели.
Самостоятельное прививание в домашних условиях
При желании кроликов можно привить и в домашних условиях, но здесь необходимо помнить, что подобное действие может нести пагубные последствия для зверька. Лучше всего обратиться за для этого нужны определенные навыки.
Для того чтобы привить кролика самому необходимо приобрести в аптеке вакцину и инсулиновый шприц. Вакцина разводится обычной чистой водой, в среднем одна инъекция составляет 0,5 мл. Укол производится внутримышечно в заднюю лапку или же под шкуру в области холки. Ветеринары советуют колоть внутримышечно, так как этот способ более надежный и эффективный. Перед введением иглы место обрабатывают спиртом для обеззараживания, после чего производят инъекцию.
ВАКЦИНА ПРОТИВ МИКСОМАТОЗА И ВИРУСНОЙ ГЕМОРРАГИЧЕСКОЙ БОЛЕЗНИ КРОЛИКОВ
СОСТАВ И ФОРМА ВЫПУСКА
Вакцину ассоциированную против миксоматоза и вирусной геморрагической болезни кроликов изготавливают из штамма В-82 вируса миксомы кроликов и штамма В-87 вируса геморрагической болезни кроликов. Вакцина представляет собой пористую сухую массу от бледно-розового до светло-коричневого цвета. Вакцину расфасовывают по 0,5. 1. 2 см3 в стерильные ампулы вместимостью 2. 3. 5. 6 см3. 4. 6 см3 во флаконы емкостью 10 и 20 см3. содержащие 5-120 иммунизирующих доз. Флаконы закрывают пробками и закатывают алюминиевыми колпачками, а ампулы запаивают. На флакон (ампулу) с вакциной наклеивают этикетку или наносят несмываемой краской маркировку с указанием: краткого наименования организации – изготовителя, краткого названия биопрепарата (вакцина против миксоматоза и ВГБК сухая), номера серии, номера контроля, даты изготовления, количества доз и срока годности. Флаконы (ампулой) с вакциной упаковывают в картонные коробки с перегородками, обеспечивающими неподвижность и целостность флаконов и (ампул). На каждую коробку наклеивают этикетку с указанием. ведомства и наименования предприятия – изготовителя, его товарного знака, наименования биопрепарата, номера серии, номера контроля, даты изготовления ( месяц, год ), срока годности, количества флаконов ( ампул ) в коробке, количества доз во флаконе (ампуле). условий хранения. обозначения настоящих ТУ и надпись «Для животных». В каждую коробку вкладывают наставление по применению вакцины.
Профилактика миксоматоза и ВГБК кроликов.
Вакцина безвредна для кроликов при внутримышечном, подкожном или внутрикожном введении. Применение вакцины согласно наставлению обеспечивает формирование напряженного иммунитета с 3-го дня после прививки, продолжительностью не менее 12-месяцев.
ДОЗЫ И СПОСОБ ПРИМЕНЕНИЯ
Вакцину применяют внутримышечно, подкожно, внутрикожно для иммунизации здоровых кроликов в благополучных, угрожаемых и неблагополучных по миксоматозу и ВГБК пунктах. В благополучных и угрожаемых пунктах кроликов иммунизируют однократно, начиная с 1,5-месячного возраста. Крольчих вакцинируют в любой период беременности. В неблагополучных пунктах по миксоматозу и ВГБК клинически здоровых кроликов и крольчат с 45- дневного возраста подвергают вакцинации. Молодняк через 3 месяца ревакцинируют. Больных животных вакцинировать запрещается. Для внутримышечного и подкожного введения вакцину во флаконах (ампулах) растворяют из расчета на 1 дозу 0,5 см3 растворителя и вводят 0,5 см3 в область бедра. Для внутрикожной инъекции вакцину во флаконах (ампулах) растворяют из расчета на 1 дозу 0,2 см3 растворителя и вводят 0,2 см3 в подхвостовое зеркало или ухо. Перед вакцинацией шприцы и иглы стерилизуют кипячением в течение 15-20 минут. Место введения вакцины дезинфицируют 70% спиртом. Каждого кролика прививают отдельной иглой. За привитым животным ведут наблюдение в течение 20 суток. Для внутрикожных прививок рекомендуется пользоваться безигольным инъектором. Техническое обслуживание инъектора проводят согласно правилам, изложенным в паспорте. Перед началом работы головку инъектора в сборе, плунжер, мандрены и запасные сопла подвергают стерилизации кипячением в дистиллированной воде в течение 15-20 минут или обрабатывают 70% спиртом. После сборки прокачку ннъектора и 2-3 пробных «выстрела» осуществляют в ватный тампон, смоченный 70% спиртом. После каждой инъекции вакцины сопло безигольного инъектора обрабатывают погружением его на 1-3 секунды в 70 процентный спирт.
Вакцина пригодна для применения в течение 18 месяцев с даты изготовления при условии хранения ее в сухом и темном месте при температуре +2-8 С. Флаконы (ампулы) с вакциной, содержащие плесень, постороннюю примесь, не разбившиеся при встряхивании хлопья, а также с нарушением укупорки и целостности бракуют. Выбракованную сухую вакцину, а также разведенную, но неиспользованную в течение 4 часов, обеззараживают кипячением в течение 20 минут.
"Всероссийским НИИ ветеринарной вирусологии и микробиологии"
601121, г. Покров Владимирской области Тел. (09243) 6-10-56; 6-13-85.
Существует нескольковакцин против пастереллеза кроликов . Например, формолвакцина против пастереллеза кроликов жидкая или вакцина против пастереллеза кроликов инактивированная (Пасоринол). Рассмотрим их более детально.
Формолвакцина против пастереллеза кроликов.
Применяется для иммунизации клинически здоровых животных в неблагополучных и угрожаемых по пастереллезу хозяйствах. Эта вакцина против пастереллеза кроликов имеет вид прозрачной жидкости с коричневым оттенком. Выпускается во флаконах по 20, 100 и 200 см3. Она содержит инактивированную взвесь культур пастерелл с добавлением агара в качестве адъюванта. После вакцинации иммунитет вырабатывается через 14-21 день после введения повторной дозы вакцины и имеет свойство сохранятся на протяжении шести месяцев. Формолвакцина против пастереллеза кроликов вводится внутримышечно по инструкции:
? кролики в возрасте с 20 дня до 3-хмесяцев: при первой вакцинации – 1 мл, при второй – 2 мл;
? кролики в возрасте от 3 до 12 месяцев: при первой вакцинации – 1,5 мл, при второй – 3 мл.
Хранить формолвакцину против пастереллеза кроликов нужно в темном сухом месте при температуре +2+15оС. Срок ее годности – 12 месяцев.
Вакцина против пастереллеза кроликов инактивированная (Пасоринол).
Состоит из суспензии Pasteurella multocida A,D, формальдегида, липоидного адъюванта и мертиолата натрия. Используется для предохранительных прививок против пастереллеза кроликов. Дозировка зависит от вида животных. Для кроликов дозировка следующая:
? кролики в возрасте 4-6 недель – по 0,5 мл;
? кролики в возрасте от 7-ми недель – по 1 мл.
Рекомендуется проводить первую вакцинацию в 4 недели, вторую – в 4 недель, третью – в 10 недель (племенным кроликам). Дальше иммунизацию проводят один раз через каждые полгода. Вакцина против пастереллеза кроликов инактивированная вводится подкожно, перед использованием нагревается до 15-25оС, а содержимое флакона тщательно взбалтывается. Хранить вакцину нужно в сухом темном месте при температуре +2+8оС. Нельзя допускать замерзания вакцины. После вскрытия использовать содержимое нужно в течение десяти часов. Препарат нельзя применять после истечения срока годности, что указан на упаковке.
С уважением, Наталья.
Тема: Ветеринарная вирусология
Это биопрепараты, содержащие штаммы вирусов, утратившие способность вызывать клинически выраженное заболевание, но сохранившие способность репродуцироваться в организме восприимчивого животного и стимулировать выработку факторов специфического противовирусного иммунитета.
Принцип получения живых вакцин. Основным в технологии производства живых вакцин является получение аттенуированных штаммов вирусов путем:
1) адаптации патогенных вирусов к маловосприимчивым или совсем невосприимчивым лабораторным животным. Так был получен штамм ЛЗ Накамура для профилактики чумы крупного рогатого скота (путем серийных пассажей на кроликах), штамм К для профилактики чумы свиней. При пассажах на животных успех во многом зависит от выбора метода заражения. Так, Л. Пастер путем серийных (130—140) интрацеребральных пассажей уличного вируса бешенства на кроликах получил вакцинный штамм, известный под названием вирус-фикс. Получены аттенуированные штаммы вирусов инфекционного бронхита, инфекционного ларинготрахеита птиц, катаральной лихорадки овец и другие путем адаптации к куриным эмбрионам. Методом адаптации к культурам клеток (пассирование в сочетании с селекцией в культуре клеток) вируса чумы крупного рогатого скота (штамма ЛЗ Накамура) удалось получить аттенуированный ареактогенный вакцинный штамм ЛТ. Аналогичным путем получены вакцинные штаммы вирусов инфекционного ринотрахеита, парагриппа-3, вирусной диареи крупного рогатого скота, чумы плотоядных и др.
При многочисленных серийных пассажах вируса происходит накопление случайных мутаций.
В основе изменчивости вируса лежат мутации, т. е. изменения состава и последовательностей нуклеотидов вирусного генома.
Исследователь, используя различные методы селекции, отбирает штаммы по признаку утраты вирулентности (к естественно восприимчивому животному) при сохранении иммуногенности. Это очень длительная, кропотливая работа, которая не всегда может быть успешной;
2) селекции природно-ослабленных штаммов вирусов при атипично или латентно протекающих инфекциях. Так были выделены вакцинные штаммы вируса болезни Ньюкасла В1, Н, Ф, Ла Сота, Бор-74 (ВГНКИ), аттенуированные штаммы ротавирусов человека;
3) использование гетеротипичных антигеннородственных апатогенных штаммов в качестве живых вакцин. Например, вирус оспы голубей создает иммунитет против оспы кур; вирус герпеса индеек защищает кур от болезни Марека; вирус фиброматоза создает у кроликов иммунитет от миксоматоза; вирус кори человека в состоянии защитить щенков от чумы плотоядных;
4) аттенуация вирусов генно-инженерными методами. Этот метод конструирования стабильных аттенуированных штаммов связан с делеционными (делеция — выпадение одного или нескольких нуклеотидов в вирусном геноме) мутациями. Преимущество таких мутантов состоит в том, что их способность к реверсии практически исключается. Исходя из этого, прилагаются усилия для получения стабильных делеционных мутаций, которые бы обеспечили вирусу достаточную дефектность, делающую его аттенуированным, но не настолько, чтобы потерять жизнеспособность. Этот тип «генной хирургии», использующий рестрикционные эндонуклеазы, может быть исполнен только на ДНК. Следовательно, те вирусные геномы, которые представлены РНК, должны быть транскрибированы в ДНК-копии, а затем подвергнуты изменениям.
Первые успехи в аттенуации вирусов с использованием методов генной инженерии достигнуты в опытах с ДНК-содержащими вирусами животных. Делеционные мутанты по тимидинкиназе получены у вируса инфекционного ринотрахеита крупного рогатого скота и вируса болезни Ауески. Так, мутанты вируса инфекционного ринотрахеита вследствие делении в гене тимидинкиназы не способны кодировать синтез этого фермента в клетках инфицированного организма. Нарушение этой функции генома вируса сопровождается его аттенуацией при сохранении антигенных свойств.
Основное требование к живым вакцинам на основе делеционных мутантов вирусов — их выраженная репликация in vitro и in vivo с тем, чтобы производство вакцин было экономически выгодным, а применение достаточно эффективным.
Любой вакцинный штамм должен быть хорошо изучен, клонирован, паспортизирован и комиссионно сдан во Всероссийский государственный научно-исследовательский институт контроля, стандартизации и сертификации ветеринарных препаратов, где он хранится, поддерживается и контролируется.
Так как свойства вакцины определяются вакцинным штаммом, то к ним предъявляются следующие основные требования:
генетическая стабильность — способность сохранять свои свойства в различных условиях пассирования на восприимчивых животных, в системе культивирования, хранения и т. д. т. е. штамм не должен подвергаться реверсии (возврату в исходное состояние);
безвредность — вакцинный штамм не должен вызывать клиническую картину болезни, вместе с тем должен обладать способностью «приживаться» (размножаться) в организме естественно восприимчивых животных. От длительности приживаемости обычно зависят продолжительность и напряженность иммунитета. Высокоиммуногенные штаммы приживаются в организме на 2—4 нед.
При идеальном исходе аттенуации вирус должен практически утрачивать способность поражать клетки-мишени, но сохранять способность размножаться в других клетках, обеспечивая создание выраженного и напряженного иммунитета при минимальной реактогенности и полной безопасности.
Живые вакцины обладают рядом существенных преимуществ перед инактивированными вакцинами:
1) создают высокую напряженность и длительность иммунитета (более чем на 1 год, иногда на всю жизнь), так как в организме вакцинные штаммы размножаются, вызывая развитие вакцинной реакции, сходной с естественным постинфекционным процессом, происходит активация всех компонентов иммунной системы, стимулируется общий (системный) и местный ответ;
2) требуются малые прививочные дозы и для большинства из них однократное введение;
3) возможное применение их не только подкожно, внутримышечно, но и перорально, интраназально и аэрозольно;
4) иммунитет вырабатывается в более короткий срок, на первых этапах обычно за счет интерферона, а затем уже — накопления вируснейтрализирующих антител;
5) технология и экономичность изготовления их превосходят создание инактивированных вакцин.
Несмотря на преимущества живых вакцин по некоторым позициям, у них есть недостатки:
1) иногда возможны поствакцинальные осложнения у молодых, ослабленных и беременных животных;
2) возможно, хотя и в редких случаях, внесение в организм животных контаминантов (латентных вирусов, микроорганизмов), загрязняющих вакцины. Например, культуры клеток из тканей крупного рогатого скота нередко инфицированы аденовирусами, вирусами диареи, парагриппа-3; куриные эмбрионы — вирусами лейкозно-саркоматозного комплекса, аденовирусами, микоплазмами; культуры клеток свиного происхождения — парвовирусами, классической чумы свиней. Неконтролируемое попадание посторонних агентов в вакцину может привести к серьезным последствиям;
3) возможна реверсия вакцинного штамма;
4) живые вакцинные штаммы весьма чувствительны к неблагоприятным факторам, возникающим при производстве, хранении, транспортировке и применении;
5) нужен довольно длительный срок для получения аттенуированных вакцинных штаммов.
Генетический механизм аттенуации недостаточно изучен. Это обстоятельство не дает возможности предложить единое правило получения вакцинных штаммов. Несмотря на попытки многих исследователей, до сих пор не получено аттенуированных вакцинных штаммов вирусов ящура, инфекционной анемии лошадей и др.
Живые вакцины широко применяют в основном для животных на откорме и не рекомендуются в репродуктивных стадах. Готовят их на биофабриках, биокомбинатах или других предприятиях по производству биопрепаратов, которые получают вакцинные штаммы из Всероссийского государственного научно-исследовательского института контроля, стандартизации и сертификации ветеринарных препаратов.
Таким образом, технология изготовления живых вакцин сводится к культивированию вакцинного штамма в какой-либо биологической системе (животные, эмбрионы птиц, культуры тканей и клеток); определению концентрации вируса (его титра) в вируссодержащем материале; контролю на стерильность (отсутствие посторонних контаминантов); фасовке и лиофилизации (перед лиофилизацией для сохранения биологической активности вируса добавляют стабилизирующие вещества). Затем вакцины проходят контроль на стерильность, биологическую активность, реактогенность, безвредность, антигенную и иммуногенную активности. Если вакцина отвечает всем установленным показателям, ее этикетируют и выпускают для применения.
Живую вакцину обычно называют вирусвакциной. Анализ данных применения живых вакцин свидетельствует о достаточно высокой эффективности многих из них, например, таких, как вакцины против чумы крупного рогатого скота, чумы плотоядных, болезни Ньюкасла и др.
С уважением, Наталья.
Тема: Ветеринарная вирусология
Это наиболее сложные по составу биопрепараты.
Для получения их обычно используют эпизоотические вирулентные вирусы. Их подвергают щадящей обработке (инактивации), которая приводит к необратимой утрате способности вируса размножаться (репродуцироваться), но при этом сохраняются его антигенные и иммуногенные свойства. Следовательно, в инактивированной вакцине должен быть «убит» вирусный геном (нуклеиновая кислота) и не должны подвергаться изменениям белки, гликопротеины, полисахариды вируса, так как иммунный ответ обусловлен главным образом веществами поверхности капсида вируса. В результате вирус утрачивает способность к репродукции и инфицированию, но сохраняет способность стимулировать у животных специфические факторы иммунитета.
Изготовление инактивированных вакцин также начинается с выбора производственного штамма вируса (с учетом основных его биологических свойств), культивирования и накопления производственного штамма вируса в чувствительной биологической системе (животные, эмбрионы птиц, культура клеток). Затем вируссодержащий материал подвергают очистке и концентрированию различными методами (низкоскоростное центрифугирование, фильтрование, ультрацентрифугирование и др.). Очистка и концентрирование вирусных агентов — важный этап, так как «убитый вирус» не размножается в организме, и для получения достаточно интенсивного иммунного ответа необходимо вводить значительное количество вирусного материала. Суспензии вируса должны быть очищены от балластных веществ (фрагментов клеточных структур, невирусных белков, липидов и др.), которые дают дополнительную нагрузку на иммунную систему организма и значительно снижают специфичность и напряженность иммунных реакций. Полученная после очистки и концентрации вируссодержащая суспензия подвергается инактивации. В случае особо опасных вирусов инактивация предшествует процессу очистки. При этом необходимо иметь в виду, что балластные вещества препятствуют процессу инактивации.
Важным условием эффективности вакцин является выбор инактиватора и оптимальных условий инактивации, позволяющих полностью лишить вирус инфекционности при максимальном сохранении антигенности. Однако механизм инактивирующих воздействий недостаточно изучен и их использование зачастую эмпирическое.
Для инактивации вирусов используют физические и химические методы. Из физических методов наиболее распространенными являются ?-лучи, УФ-лучи, воздействие температуры, реже ультразвука, фотодинамическое воздействие некоторых красителей (метиленовая синька, акридиновый оранжевый, толуидин и др.). Наиболее уязвимыми мишенями для ?-лучей являются пуриновые и пиримидиновые основания. Белковая оболочка под воздействием радиации повреждается незначительно. Этот метод дает возможность одновременно надежно инактивировать и стерилизовать готовый препарат.
Эффективность УФ-лучей определяется их проницаемостью и адсорбцией биологическими молекулами. Белки поглощают УФ-лучи в меньшей степени, чем нуклеиновые кислоты и поэтому более устойчивы к их действию. Полагают, что под влиянием УФ-лучей в нуклеиновой кислоте образуются димеры между соседними пирамидиновыми основаниями, а также ковалентные связи между нуклеиновой кислотой и белковой оболочкой.
В практике создания инактивированных вакцин наиболее широкое применение получили химические инактиваторы, такие, как формальдегид (присоединение формальдегида к аминогруппам пуринов и пиримидинов уничтожает матричную и информационную активность нуклеиновых кислот), ?-пропиолактон, этиленимины, гидроксиламин (инактивирующее действие определяется его взаимодействием с пиримидиновыми основаниями нуклеиновой кислоты, зависящим от величины pH) и др. Реагенты, которые используют для инактивации вирусов, являются мутагенами, поэтому инактиватор должен либо подвергнуться самораспаду ?-пропиолактон, гидроксиламин), либо переведен в неактивную форму (нейтрализован), а продукты нейтрализации — остаться безопасными.
После инактивации осуществляют контроль на авирулентность, направленный на выявление оставшихся жизнеспособных вирионов. Степень безопасности инактивированных вакцин неразрывно связана с чувствительностью тест-системы, по которой оценивается полнота инактивации вируса. Для этой цели используют чувствительные культуры клеток животных, в том числе эмбрионов птиц. При этом репродукции вируса быть не должно.
Индивидуальный подход определяется свойствами вируса, особенностями болезни, чувствительностью биологических систем. Так, авирулентность вакцин против ящура определяют на крупном рогатом скоте (это более надежно), на свиньях, лабораторных животных и культуре клеток; вакцину против бешенства — на белых мышах; вакцину против болезни Ауески — на кроликах или в культуре клеток, которую использовали для накопления вируса; вакцину против болезни Ньюкасла — на куриных эмбрионах (не менее трех слепых пассажей). Если производственный штамм вируса, который используют для получения вакцины, культивируется в культуре клеток и вызывает характерные цитопатические изменения, то общепризнанным методом является испытание инактивированных препаратов в чувствительных культурах клеток (не менее трех слепых пассажей). Однако при оценке безопасности некоторых вакцин используют сложные комплексные подходы.
Для повышения иммуногенной активности вакцины в ее состав вводят адъюванты — вещества разнообразной химической природы, неспецифически стимулирующие иммунный ответ к различным антигенам. В качестве адъювантов используют: гидроксид алюминия, аэросил, минеральные масла, ДЭАЭ-декстран, сапонин; кроме того, используют синтезированные вещества — мурамилдипептид, полианионы, поликатионы и др. Механизмы действия адьювантов разнообразны и до конца не изучены. Одни из них вызывают воспалительную реакцию, другие способствуют депонированию антигенов и замедляют их гидролиз, третьи способствуют усилению поглощения антигенов макрофагами и антиген-представляющими клетками.
К адъювантам предъявляют следующие требования: они должны быть нетоксичными в используемых дозах, не вызывать побочных реакций в организме, сами не обладать антигенной активностью, должны стимулировать развитие длительного гуморального и клеточного иммунитета.
После добавления адъюванта вакцину контролируют на отсутствие посторонних контаминантов (бактерий, грибов) путем посева на питательные среды (МПА, МПБ, МППБ, Сабуро или Чапека). Роста микроорганизмов не должно быть. Затем вакцину фасуют во флаконы и этикетируют. Окончательный контроль вакцины на основные показатели: авирулентность, стерильность, безвредность, допустимую степень реактогенности (на восприимчивых животных), антигенную и иммуногенную активность (на лабораторных и восприимчивых животных) осуществляют государственные контролеры в соответствии с техническими условиями на данный препарат.
Инактивированные вакцины отличаются большей стабильностью свойств, они безопаснее. Их применяют для животных любого возраста и в репродуктивных стадах. Такие вакцины используют преимущественно с профилактической целью в благополучных хозяйствах и угрожаемых зонах. Однако эти вакцины имеют некоторые недостатки:
технология их изготовления гораздо сложнее, что связано с необходимостью получения большого количества вируссодержащего материала, очистки, концентрации антигена, инактивации вирусного генома и включения в состав вакцины адъювантов;
необходимо проводить прививки многократно и в значительных дозах;
они индуцируют менее напряженный и длительный иммунитет, чем при использовании живых вакцин;
применять их возможно только парентерально;
они слабее стимулируют Т-систему иммунитета и местный иммунный ответ, поэтому резистентность слизистых оболочек верхних дыхательных путей и пищеварительного тракта бывает менее выражена, чем после применения живых вакцин;
способны иногда вызывать аллергическое состояние после повторной вакцинации.
Технология производства инактивированных вакцин сложнее, чем живых вакцин, и состоит из следующих этапов:
выбор производственного штамма;
культивирование вируса в биологической системе;
определение концентрации вируса (антигена);
инактивация, очистка и концентрация вирусного материала;
добавление адъюванта;
внутрицеховой контроль;
расфасовка, этикетирование;
заключительный контроль на стерильность, авирулентность, безвредность, реактогенность, антигенную и иммуногенную активность.
Помимо традиционных цельновирионных вакцин (живых, инактивированных) разработаны методы создания вакцин новых поколений: субъединичных, синтетических, получаемых методами генной инженерии. Совершенствование вакцин шло в направлении снижения количества балластных компонентов, снижения реактогенности и повышения иммуногенности препарата.
Тема: Ветеринарная вирусология
Это — специфические или иммунные белки, образующиеся в организме под воздействием различных антигенов в результате естественной инфекции или искусственной иммунизации.
Антитела обладают важнейшим свойством — вступать в специфическую связь с гомологичным антигеном. Они реагируют с теми антигенами, против которых выработаны, и подходят к ним как отпечаток к пальцу. Специфичность антител определяется их активными центрами, которые находятся в тяжелых и легких пептидных цепях молекулы антитела.
Активными центрами антител называют сравнительно небольшие участки молекулы антитела, которые непосредственно вступают в реакцию с детерминантной группой антигена и определяют специфичность их взаимодействия.
Молекула антитела имеет от 2 (IgG) до 10 (IgM) активных центров, определяющих ее валентность.
Различают антитела полные и неполные. Полные антитела (имеют не менее двух активных центров), соединяясь с антигеном образуют визуальный феномен в пробирке (преципитацию и др.).
Неполные антитела (блокирующие) не дают видимой реакции, но они нейтрализуют активность вируса. Для выявления в сыворотках крови неполных антител в серологические реакции вводят дополнительные компоненты (РНСК для выявления).
Обычно источниками антител в серологических реакциях служат сыворотки крови животных, но их обнаруживают и в секретах слизистых оболочек, лимфе и других жидкостных фазах организма.
Функцией антител наделены ?-глобулины. Белки, функционирующие как антитела, объединены в группу под названием «иммунные глобулины» (Ig). Различают пять главных классов иммуноглобулинов: IgA, IgG, IgM, IgD, IgE. Наиболее хорошо изучены IgG, IgM и IgA.
IgM — основной класс антител, выделяемых в крови на ранних стадиях первичного иммунного ответа (10 активных центров, процент в глобулинах сыворотки — 5—10, период полужизни = 5 сут).
IgG — при первичном иммунном ответе появляются позднее, чем IgM, однако они являются основным классом антител, находящихся в крови при повторном ответе (2 активных центра, процент в глобулинах сыворотки — 80—85, период полужизни = 23 сут).
IgA — основной класс антител в секретах (молоке, слюне, слезах, секретах дыхательных путей, урогенитального и пищеварительного трактов). В сыворотке крови содержится около 13—14 % IgA от общего количества иммуноглобулинов, период полужизни 6 дней. У сывороточных IgA —2 активных центра, у секреторных — 4. Секреторные IgA играют существенную роль в защите от кишечных и респираторных инфекций, обеспечивают первую линию защиты (местный иммунитет).
IgD и IgE в сыворотке крови очень мало. IgE имеют значение в развитии аллергических реакций. IgD обусловливают развитие аутоиммунных процессов и, возможно, препятствуют возникновению толерантности.
При соединении антигена с антителом происходит взаимодействие между поверхностью антигенной детерминанты и активным центром иммуноглобулина, находящимся в вариабельной его части таким путем, что комплементарные друг другу поверхности соединяются физико-химическими связями. Связь эта хотя и прочная, тем не менее обратима, т. е. при определенных условиях (ультразвук, ультрацентрифугирование, обработка папаином и др.) из комплекса антиген + антитело можно выделить активный вирус и антитела.
Чем ближе соответствие антигенной детерминанты и активного центра антитела, тем интенсивнее электростатическое притяжение и гидрофобное взаимодействие между ними, выше аффинитет и прочнее комплекс (антиген + антитело). Различают авидные и неавидные антитела. Авидные антитела «жадно» вступают в реакцию с антигеном, и образуется прочный комплекс. Неавидные антитела обладают слабой способностью связывать антиген.
В серологических реакциях можно выделить две фазы:
первая фаза — специфическая, невидимая, характеризующаяся адсорбцией антител на поверхности антигена;
вторая фаза — неспецифическая, видимая, завершающаяся феноменом преципитации, лизиса, нейтрализации инфекционности вируса и т. д.
Взаимодействие антигена с антателами зависит от многих факторов: температуры (от 4 до 37 °С); pH среды; наличия электролитов и др. Оно возможно в различных соотношениях и в любых пропорциях. Однако при оптимальных концентрациях антигена и антител (когда все их валентности поглощены) реакция выражена более четко. Это явление можно иллюстрировать следующим образом. Если антиген имеет шесть детерминант, а антитело два активных центра, то:
а) при избытке антигена (в) макроагрегата нет, реакция не визуальна;
б) при избытке антител макроагрегата нет, реакция не визуальна;
в) при оптимальном количестве антител и антигена образуется макроагрегат, который хорошо виден в форме преципитата.
Тема: Ветеринарная вирусология
Иммунитет — это целостная система биологических механизмов самозащиты организма, с помощью которых он распознает и уничтожает все чужеродное (т. е. генетически отличающееся от него), если оно проникает в организм или возникает в нем.
С помощью этих механизмов поддерживается структурная и физиологическая целостность организма на протяжении всей его жизни, т. е. сохраняется физическое здоровье людей и животных и обеспечивается исцеление от многих болезней.
Наиболее опасный чужеродный материал, который необходимо распознать и убрать, — это микроорганизмы и вирусы, вызывающие инфекционные заболевания. Устойчивость к инфекции может быть естественной (т. е. врожденной) или приобретенной в результате переболевания или вакцинации.
Иммунное реагирование начинается после проникновения в организм чужеродного агента, несущего на себе признаки генетически чужеродной информации (вируса, бактерий и др.), но попасть в организм и спровоцировать иммунный ответ чужеродные агенты могут, лишь преодолев ряд защитных механизмов, которые можно рассматривать как первичную линию обороны иммунной системы. Чужеродные агенты, проникшие в организм, быстро (минуты, часы) уничтожаются механизмами естественной защиты. В противном случае начинается иммунный ответ, т. е. активация защитных механизмов против определенного (специфического) возбудителя.
Защитные механизмы противовирусного иммунитета. В понятие противовирусного иммунитета входят три категории защитных механизмов:
естественная видовая резистентность;
неспецифические факторы резистентности, включающие клеточные и физиологические реакции (интерферон, ингибиторы, температура, фагоцитоз и т. д.);
специфические факторы иммунитета, проявляющиеся при иммунизации или после переболевания (В-, Т-лимфоциты, антитела, макрофаги).
С уважением, Наталья.