








Категория: Бланки/Образцы
1 Область применения
Настоящий документ разработан в развитие «Положения о Системе аккредитации аналитических лабораторий (центров)» и устанавливает требования к документам лаборатории, аккредитуемой в Системе аккредитации аналитических лабораторий (центров).
Документ предназначен для применения аналитическими лабораториями при подготовке к аккредитации и экспертными организациями при проведении экспертизы документов, представляемых лабораториями с заявкой на аккредитацию.
2 Нормативные ссылкиВ настоящем документе использованы ссылки на следующие документы:
ГОСТ 8. 417 –2002 Государственная система обеспечения единства измерений. Единицы величин
ГОСТ 2.105 Единая система конструкторской документации. Общие требования к текстовым документамГОСТ 16504 Система государственных испытаний. Испытания и контроль качества продукции. Основные термины и определения
ГОСТ Р 1.12-2004 Стандартизация в Российской Федерации. Термины и определения
ГОСТ Р ИСО 9001-2001 Системы менеджмента качества. Требования
ГОСТ Р ИСО/МЭК 17025-2006 Общие требования к компетентности испытательных и калибровочных лабораторий
ISO 10012:2003 Системы менеджмента измерений. Требования к измерительным процессам и измерительному оборудованию
ISO/IEC 17000:2004 Оценка соответствия. Словарь и общие принципы
ISO/IEC 17011:2004 Оценка соответствия. Общие требования к органам по аккредитации, аккредитующим органы по оценке соответствия
РМГ 29-99 Государственная система обеспечения единства измерений. Метрология. Основные термины и определения
РМГ 76-2004 Государственная система обеспечения единства измерений. Внутренний контроль качества результатов количественного химического анализа
Руководство СITAC/Eurachem Guide. Руководство по качеству в аналитической химии. Помощь при аккредитации
Документ СААЛ «Требования к документам, выдаваемым аналитическими лабораториями по результатам выполненных аналитических работ. Рекомендации по оформлению».
Определения и сокращения 3.1 В настоящем документе использованы определения, принятые в «Положении о системе аккредитации аналитических лабораторий (центров)». 3.2 В настоящем документе приняты следующие сокращения: СААЛ - Система аккредитации аналитических лабораторий (центров) ЭО - экспертная организацияНД - нормативный документ
МСИ - межлабораторные сравнительные испытания
СИ - средства измерений
ВО - вспомогательное оборудование
ИО - испытательное оборудование
СО - стандартный образец
СОП - стандартный образец предприятия
АС - аттестованная смесь
Лаборатория - аналитическая (испытательная) лаборатория (центр)
4 Требования к содержанию и оформлению Положения об аккредитованной лаборатории 4.1 Общие положения 4.1.1 Положение об аккредитованной лаборатории должно устанавливать порядок функционирования аккредитованной лаборатории. В Положении должны быть определены статус лаборатории, ее место в структуре юридического лица (если она не имеет статуса юридического лица), структура лаборатории, функции, права, обязанности, ответственность лаборатории, ее взаимодействие с внутренними подразделениями организации и другими организациями при проведении работ в области аккредитации.4.1.2 Положение об аккредитованной лаборатории разрабатывается на основе действующего Положения о лаборатории с учетом требований ГОСТ Р ИСО/МЭК 17025-2006 и настоящего документа.
Положение об аккредитованной лаборатории распространяется только на деятельность лаборатории в области аккредитации и ограничено сроком действия аттестата аккредитации.
4.1.3 Положение об аккредитованной лаборатории (далее - Положение) должно быть согласовано руководителем рабочего аппарата СААЛ - начальником управления метрологии Росстандарта и утверждено руководителем организации, в состав которой входит лаборатория, или руководителем лаборатории (если лаборатория имеет статус юридического лица).
4.1.4 С Положением должен быть ознакомлен весь персонал аккредитованной лаборатории.
4.1.5 Положение подлежит пересмотру при смене юридического лица, реорганизации юридического лица (лаборатории), изменении области аккредитации лаборатории.
4.1.6 Рекомендуемые разделы Положения:
- взаимодействие лаборатории со структурными подразделениями организации и другими организациями;
4.1.7 При заполнении Положения рекомендуется использовать шрифт «Arial» размером 12 или 14 и учитывать требования ГОСТ 2.105.
4.2 Требования к содержанию разделов Положения
4.2.1 Раздел «Содержание» должен включать название разделов и указание страниц.
4.2.2 В разделе «Введение» указывают область распространения документа, организацию или структурное подразделение, в котором действует Положение, срок его действия, указывают документы в соответствии с которыми разработано Положение об аккредитованной лаборатории, описывают порядок внесения изменений и пересмотра Положения.
4.2.3 В разделе «Структура» приводят наименование лаборатории, наименование организации, в структуру которой входит лаборатория (если она не является юридическим лицом) и место лаборатории в ее структуре, данные об утверждении Устава организации, номер и дату приказа о создании лаборатории; описывают административную и функциональную подчиненность лаборатории, приводят сведения о руководителе лаборатории и менеджере по качеству (как бы он не назывался), порядке их назначения и замещения, описывают организационную структуру лаборатории, функции каждой структурной единицы и порядок взаимодействия между подразделениями лаборатории (рекомендуется приведение структурной схемы лаборатории).
4.2.4 В разделе «Область аккредитации» приводят сведения о целях и задачах, решаемых лабораторией, объектах аналитических работ, назначении проводимых работ и сфере использования получаемых лабораторией результатов аналитических работ в области, закрепленной аттестатом аккредитации.
Указывают документы, которыми руководствуется лаборатория при организации работ (законы, законодательные акты, Устав предприятия, планы - графики, договоры, Руководство по качеству и т.п.).
Описывают мероприятия, направленные на исключение возможности оказания на лабораторию административного, коммерческого, финансового или иного воздействия, которое может повлиять на объективность и достоверность результатов измерений, испытаний, анализа (далее - испытаний).
4.2.5 В разделе «Функции лаборатории» приводят перечень функций, реализуемых лабораторией при проведении работ в области аккредитации (проведение КХА, измерений, отбор проб и т.п.).
Указывают документы, определяющие функции персонала лаборатории (должностные инструкции, рабочие инструкции и т.п.).
4.2.6 В разделе «Права лаборатории» приводят все права, предусмотренные Уставом (если лаборатория является юридическим лицом), или права, которые переданы лаборатории юридическим лицом (право заключения договоров на проведение аналитического контроля, право устанавливать формы протоколов, право иметь собственную печать, право на разработку внутренних документов, регламентирующих деятельность лаборатории и т.п.). В разделе особо отмечают права, которые дает статус аккредитованной лаборатории:
ссылаться на факт аккредитации лаборатории в документах (протоколах, отчетах и др.), содержащих результаты аналитических работ и рекламных материалах;
использовать в выдаваемых потребителю документах, содержащих результаты аналитических работ, знак СААЛ;
выполнять на договорной основе аналитические работы в области, определенной аттестатом аккредитации;
устанавливать расценки на проведение аналитических работ (включая надбавки за проведение аналитического контроля в аккредитованной лаборатории);
заключать с другими аккредитованными лабораториями субподрядные договора на проведение аналитических работ;
опротестовывать решения по любым вопросам своей аккредитации в комиссии по апелляциям;
давать предложения по разработке и корректировке документов СААЛ.
В разделе также указывают документы, определяющие права персонала лаборатории.
4.2.7 В разделе «Обязанности лаборатории» приводят информацию:
об обязанностях, вытекающих из требований законодательства и нормативных документов, относящихся к деятельности лаборатории;
об обязанностях, которые должна выполнять лаборатория в процессе функционирования, в том числе обеспечение достоверности, объективности и требуемой точности результатов испытаний, выполнения требований заказчиков;
указывают обязанности руководителя лаборатории, связанные с необходимостью разработки целей и задач в области качества, внедрения системы менеджмента и постоянного повышения ее эффективности.
В разделе особо указывают обязанности, налагаемые статусом аккредитованной лаборатории:
постоянно поддерживать свое соответствие критериям аккредитации;
указывать область аккредитации при ссылках на факт своей аккредитации;
сообщать ЭО об изменениях, влияющих на соответствие лаборатории критериям аккредитации;
обеспечивать условия для осуществления инспекционного контроля деятельности аккредитованной лаборатории, включая обеспечение доступа в лабораторию экспертов по аккредитации, назначенных экспертной организацией, предоставление им необходимой документации, своевременную оплату расходов экспертной организации в соответствии с установленным порядком;
предоставлять заказчику (по его запросу) возможность ознакомления с условиями проводимых для него работ;
вести учет всех предъявляемых претензий (рекламаций) по результатам аналитических работ и инспекционного контроля;
улучшать качество обслуживания заказчиков;
предоставлять ЭО отчеты о результатах своей деятельности (по ее запросу);
при проведении работ по субподряду заключать договора только с аккредитованными лабораториями, уведомлять заказчика о субподряде, нести ответственность за работу, выполняемую по субподряду, вести регистрацию всех работ, выполняемых по субподряду;
использовать права аккредитованной лаборатории только в течение срока и в пределах области действия аттестата аккредитации;
обеспечивать конфиденциальность сведений, полученных в процессе выполнения заказов (за исключением случаев, предусмотренных законодательством);
участвовать в проверках квалификации лаборатории посредством МСИ, организуемых в рамках СААЛ;
содействовать в проведении работ по зарубежному и (или) международному признанию аккредитованных аналитических лабораторий и (или) СААЛ в целом;
постоянно улучшать систему менеджмента качества лаборатории;
не принимать участия в деятельности, которая может вызвать сомнение в независимости и беспристрастности лаборатории;
не иметь финансовой, коммерческой или иной заинтересованности в получении конкретных результатов аналитических работ.
В разделе, кроме того, указывают, документы, определяющие обязанности персонала лаборатории.
4.2.8 Раздел «Ответственность» должен содержать заявление о персональной ответственности начальника лаборатории за реализацию переданных прав, осуществление функций и обязанностей, возложенных на лабораторию, в том числе:
за объективность и достоверность результатов испытаний;
за правильность оформления документов, выдаваемых лабораторией по результатам испытаний;
за соблюдение сроков выполнения работ и условий оплаты, установленных договорными отношениями;
за состояние охраны труда в лаборатории;
за результативность системы менеджмента качества лаборатории.
В разделе указывают документы, определяющие ответственность персонала лаборатории.
4.2.9 В разделе «Взаимодействи е» приводят сведения о взаимодействии лаборатории:
с подразделениями организации, в структуру которой входит лаборатория, в том числе с руководством организации;
с другими организациями: службами государственного контроля и надзора, заказчиками, поставщиками, с другими испытательными лабораториями и центрами и т.п.;
со структурными элементами СААЛ.
4.2.10 В разделе «Финансовое обеспечение» приводят информацию:
- о финансовых ресурсах, обеспечивающих стабильную работу лаборатории, а также оплату всех работ, связанных с аккредитацией лаборатории;
о порядке оплаты работ персонала лаборатории, в том числе выполняемых на договорной основе для сторонних организаций;
о независимости вознаграждения персонала лаборатории от полученных результатов аналитических работ.
4.3 Требования к оформлению
4.3.1 Каждый лист Положения должен содержать информационный колонтитул, включающий: наименование лаборатории и наименование организации, в состав которой она входит (если лаборатория не является юридическим лицом), наименование документа, номер редакции, регистрационный номер (при необходимости), номер листа, общее количество листов.
4.3.2 В случае внесения изменений в Положение об аккредитованной лаборатории в течение срока действия аттестата аккредитации, оформляют новую редакцию Положения или изменение к Положению.
Согласование и утверждение изменений к Положению и новых редакций Положения осуществляется в порядке, предусмотренном в разделе 4.1.
4.3.3 На титульном листе приводят следующие сведения:
- в верхней части титульного листа указывают наименование организации, в состав которой входит лаборатория, если она не является юридическим лицом или наименование лаборатории;
в центре титульного листа располагают название документа, наименование лаборатории и номер редакции документа.
- в левой верхней части титульного листа располагают гриф согласования;
- в правой верхней части титульного лист располагают гриф утверждения.
Подписи должностных лиц, согласовавших и утвердивших Положение, должны быть заверены печатью.
В правой нижней части титульного листа располагают подпись руководителя лаборатории (если лаборатория входит в состав юридического лица).
В центре нижней части титульного листа располагают наименование населенного пункта, в котором расположена лаборатория и год составления Положения о лаборатории.
Рекомендуемая форма титульного листа Положения об аккредитованной лаборатории приведена в приложении А.
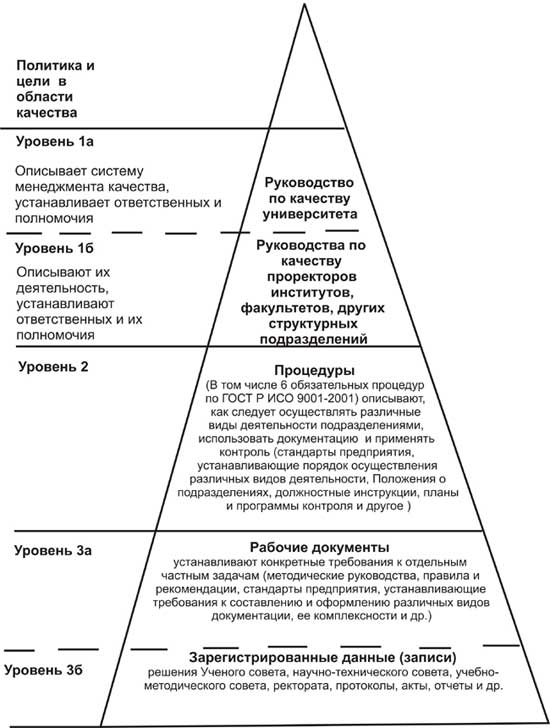
5 Требования к содержанию и оформлению Руководства по качеству
5.1.2 При разработке Руководства по качеству необходимо учитывать требования законов РФ, ГОСТ Р ИСО/МЭК 17025-2006, ГОСТ Р ИСО 9001-01, документов Государственной системы обеспечения единства измерений, ISO/IEC 17000:2004, ISO/IEC 17011:2004, ISO 10012:2003, руководства СITAC/Eurachem Guide «Руководство по качеству в аналитической химии», руководств ИЛАК и настоящего документа.
5.1.3 Руководство по качеству может быть:
- самостоятельным документом, включающим всю информацию о системе менеджмента качества лаборатории;
единым документом с адаптированными приложениями;
- документом, содержащим ссылки на соответствующие самостоятельные документированные процедуры, в том числе на документированные процедуры системы менеджмента качества организации.
5.1.4 Для каждой процедуры, включенной в Руководство по качеству, должны быть определены: цель или назначение, область применения, порядок действий (кто, что где, когда, как), ответственность и полномочия персонала при выполнении процедуры, какие документы (записи) оформляются по исполнении процедуры, кто контролирует ее исполнение, каким образом оценивается результативность ее выполнения.
5.1.5 Настоящие требования основаны на функциональном подходе к построению Руководства по качеству.
Руководство по качеству может быть дополнено, при необходимости, идентификационными картами основных процессов, разработанных с учетом требований ГОСТ Р ИСО 9001-2001 и приведенных в приложении Б.
5.1.6 Руководство по качеству должно быть утверждено руководителем организации, в структуру которой входит лаборатория, или руководителем лаборатории (если лаборатория имеет статус юридического лица).
5.1.7 Руководство по качеству должно быть доведено до сведения всего персонала лаборатории. Свою деятельность лаборатория должна осуществлять в соответствии с процедурами, изложенными в Руководстве по качеству. Должностные инструкции (как бы они ни назывались) персонала лаборатории должны быть приведены в соответствие с положениями Руководства по качеству.
5.1.8 Руководство по качеству подлежит пересмотру при смене юридического лица, реорганизации юридического лица (лаборатории), изменении области аккредитации лаборатории, совершенствовании системы менеджмента качества лаборатории.
5.1.9 Руководство по качеству должно включать следующие разделы:
- термины и определения
- помещения и условия окружающей среды
- приобретение услуг и запасов
- управление оборудованием и материалами
- методики испытаний, а также оценка пригодности методик
- отбор проб (образцов) объектов аналитического контроля
- обращение с пробами (образцами) объектов аналитического контроля
- отчетность о результатах
- обеспечение качества результатов испытаний
- управление работами, несоответствующими установленным требованиям
- анализ со стороны руководства
- анализ запросов, заявок на подряд и контрактов
- заключение субподрядов на проведение аналитического контроля;
П р и м е ч а н и е – Рекомендуется включение в Руководство по качеству всех разделов. Если содержание какого либо раздела, в связи со спецификой конкретной лаборатории, не является для нее актуальным, в этом разделе делается запись о том, что соответствующая процедура в лаборатории не осуществляется.
5.1.10 При заполнении Руководства по качеству рекомендуется использовать шрифт «Arial» размером 12 или 14 и учитывать требования ГОСТ 2.105.
Похожие документы:«Тверская межобластная ветеринарная лаборатория» АТТЕСТАТ АККРЕДИТАЦИИ ИСПЫТАТЕЛЬНОЙ ЛАБОРАТОРИИ (ЦЕНТРА ) В СИСТЕМЕАККРЕДИТАЦИИАНАЛИТИЧЕСКИХЛАБОРАТОРИЙ (ЦЕНТРОВ ) №РОСС RU.0001.516934, действителен.
целую подборку статей по поводу системыаккредитациианалитическихлабораторий. Да, я тоже согласен, что на. органы по сертификации и испытательные лаборатории. центры. А какие испытательные лаборатории. центры. Их очень много у нас.
тестирование с другими сертифицированными лабораториями. ?Сертификация аналитическойлаборатории включает в себя заполнение. системы качества, затем подается заявка в Польский центр по аккредитации. который осуществляет оценку деятельности лаборатории.
тестирование с другими сертифицированными лабораториями. ?Сертификация аналитическойлаборатории включает в себя заполнение. системы качества, затем подается заявка в Польский центр по аккредитации. который осуществляет оценку деятельности лаборатории.
«Системааккредитациианалитическихлабораторий (центров )». РК содержит документированные процедуры системы менеджмента качества (СК) Органа по аккредитации Ассоциации аналитическихцентров.
Внутренний контроль качества QC согласно ИСО/МЭК 17025 является неотъемлемой и важной составляющей системы контроля качества и системы менеджмента аналитической лаборатории.
В уникальном издании приведены таблицы контроля качества, процедуры, ведение документации и примеры для практического ведения внутреннего QC в лаборатории. Переведенное на 6 языков издание рекомендовано европейскими органами по надзору и аттестации как наиболее практическое руководство для повседневного использования в работе аналитических лабораторий.
Руководство содержит подробное описание технологии применения контрольных карт, включая их типы и виды, образцы и пределы для контроля, полезные уравнения и формулы, интерпретацию результатов. Даны рекомендации по введению программы контроля качества и использованию данных контрольных карт для различных целей. Многочисленные примеры качественно закрепляют теоретические основы и методические подходы.
Простота изложения материала, его наглядность делают руководство удобным и максимально практичным инструментом для специалистов химико-аналитических, экологических, медицинских и др. лабораторий, испытательных центров, центров сертификации и мониторинга, служб аттестации и надзора.
Книга не имеет аналогов в России и будет востребована отечественными специалистами лабораторий разного профиля и уровня подготовки.
2. Неопределенность измерении? и внутрилабораторная
воспроизводимость
3. Требования к качеству аналитического контроля
4. Принципы работы с контрольными картами
5. Различные типы контрольных карт
6. Различные образцы для контроля
7. Установление контрольных пределов
8. Введение программы контроля качества
9. Ежедневная обработка результатов контроля качества
10. Долгосрочные оценки данных контроля качества
11. Другие виды использования данных контроля качества
и контрольных карт
12. Терминология и формулы
15. Список литературы
Как наша испытательная лаборатория проходила аккредитацию.
Сразу хочу сказать, что аккредитацию я проходил впервые, не было у меня старших товарищей, которые могли бы направить меня в нужное русло, лаборатория создавалась почти с нуля. Всё было в новинку, всю информацию о прохождении этой процедуры я черпал из многочисленных форумов, чтения законов и нормативной документации. Шаблон руководства по качеству удалось добыть у наших метрологов, за что им большое спасибо, хотя его пришлось сильно переработать под наши задачи. Всё ещё больше осложнилось, когда грянула реформа Росаккредитации, и пришлось все сделанное переделывать под новым формам и требованиям. Всё это я пишу в качестве подсказки таким же бедолагам, как я, без опыта прохождения аккредитации, со смутным представлением о том, как всё это происходит. Так что матёрым зав. лабам моё описание покажется наивным и очевидным, но к сожалению на просторах интернета не встретишь хоть какого-то описания прохождения этой процедуры, а на безрыбье и моё плохонькое сойдёт.
Руководство нашей конторы поставило задачу – расширить и аккредитовать лабораторию под список задач для выполнения физ-хим анализа воды. Под это дело было отремонтировано помещение, куплена мебель и оборудование, лаборатория начала свою работу. После того как всё устаканилось, стали приводить в порядок внутренний документооборот, создавать систему менеджмента качества, руководство по качеству, паспорт лаборатории. Когда всё сочинили и утвердили у руководства, то приступили непосредственно к получении гос.услуги.
Пакет документов для отправки в Росаккредитацию выглядит следующим образом:
1. Заявление об аккредитации
2. Область аккредитациий лаборатории
3. Платёжное поручение об оплате государственной пошлины
4. Устав ООО «Рога и копыта»
5. Свидетельство о государственной регистрации юридического лица
6. Свидетельство о постановке на учёт юридического лица в налоговом органе
7. Выписка из единого государственного реестра юридических лиц
8. Приказ о вступлении в должность генерального директора ООО «Рога и копыта»
9. Копии дипломов об образовании персонала
10. Копии удостоверений о прохождении курсов повышения квалификации работников лаборатории
11. Копии трудовых книжек работников лаборатории
12. Руководство по качеству лаборатории
13. Паспорт лаборатории
Все эти документы необходимо отправить в бумажном и электронном виде (на флэшке или диске) заказным письмом (по факту и весу эта была бандероль) с уведомлением в московское отделение Россакредитации. Моё письмо шло 4 недели, хотя обычное письмо доходит за 3 дня. Видимо, Россаккредитаци копит входящую корреспонденцию, а потом оптом забирает или почта у нас так хорошо работает, трудно сказать. Уведомление о вручении мне так и не пришло, я контролировал ход бандероли по ID номеру посылки на сайте почты РФ. Уведомления от Россаккредитации тоже приходили, куда попало, то на юридический адрес нашей конторы, то на физический, то на электронный адрес секретариата. На мой личный адрес письма всегда доходили окольными путями от разного рода начальства через пересылку. Советую в заявлении на аккредитацию указывать свой личный электронный адрес, будет проще потом общаться.
После того как примут ваше заявление, создадут дело о предоставлении гос. услуги и ему присвоят номер, можно контролировать ход дела через сайт Росаккредитации, но если связь между вами и Россаккредитацией не налажена, то узнать свой номер проблематично, я долго общался по телефону горячей линии прежде чем удалось выяснить свой номер и фамилию куратора. Потом на сайте можно по номеру смотреть ход стадии рассмотрения дела.
После прохождения документов через государственную машину, я получил уведомление о назначении экспертной организации, которая будет заниматься моей лабораторией. По закону наша контора обязана заключить с ней договор об оказании услуг, на это даётся 30 дней, однако пока все эти приказы бродили по инстанциям и почте, у меня на всё про всё оставалось 7 дней! Мне стоило больших усилий, чтобы в такой короткий срок с нашей корпоративной бюрократией заключить этот договор, потому что нашлась куча желающих внести изменения в текст договора. В итоге договор заключили стоимость аккредитации составила 150 тыс рублей (70 тыс за документарную проверку и 80 тыс рублей за выездную проверку) аккредитовывались по 25 методикам физ-хим анализа.
После заключения договора эксперт, осуществляющий проверку документов, стал запрашивать все документы в электронном виде, какие были отправлены в Москву и сверх того:
1. Приказ о назначении руководителя лаборатории
2. Приказ о назначении уполномоченного по качеству (у нас это один и тот же человек, что и руководитель лаборатории)
3. Приказ о внедрении системы менеджмента качества
4. Карты аттестации рабочих мест по условиям труда
5. Аттестация персонала лаборатории внутренней комиссией на компетентность (у нас их не спрашивали, у наших метрологов требовали)
6. Копии всех свидетельств о поверке СИ
7. Копии должностных инструкций
8. Копия официальной схематичной структуры конторы из отдела кадров с подписями и печатями (не та которая в РК присутствует, а официальная!)
9. Копия штатного расписания лаборатории
10. Копии личных учётных карточек персонала из отдела кадров.
11. Копии трудовых договоров с персоналом
12. Договор на покупку реактивов
13. Договор на покупку приборов
14. Договор на покупку программного обеспечения (не лицензионные коробочки Windows и MS Office, а договор с конторой, где мы их покупали)
15. Договор на покупку нормативной документации и методик хим анализа (то есть наличие синей печати на методики экспертов уже не устраивает, надо доказать что вы их купили, а не одолжили на время)
16. Договор аренды помещений
17. Доказательство нахождения в собственности оборудования, средств измерения (мы предоставляли инвентарную опись, взятую в бухгалтерии)
18. Договор на поверку средств измерения
19. Договор на переобучение или повышения квалификации персонала (у нас они были разовые на каждого сотрудника в отдельности)
20. Договор на участие в межлабораторных испытаниях (если не участвовали, то для следующей проверки надо заключить такой договор и поучаствовать)
21. Календарные графики на всё (на отбор проб, на повышение квалификации, внутрилабораторный контроль, на внутренние аудиты, на поверку СИ и тд)
22. Политика в области качества должны быть подписана генеральным директором с печатью и являться отдельным документом, лучше в 2-3 экземплярах (что бы и на стене висела и в РК и в Паспорте лаборатории была)
Часть из этого списка потом неожиданно всплывёт в приказе на выездную экспертизу, часть будут требовать эксперты на месте, я не стал разделять этот список, а свалил всё в кучу. Некоторые отсутствовавшие у меня документы пришлось досылать уже после проверки, в основном это были договоры на покупку всего на свете.
Последний раз редактировалось Tokashi Ср мар 25, 2015 6:07 pm, всего редактировалось 2 раза.
Энергия ядерного взрыва примерно равна 20 Тера кал, что эквивалентно 4 Кило тоннам копчёной колбасы!
![]()
Документальная проверка ничего особого из себя не представляет, эксперт несколько раз звонил, писал, уточнял кое-какие моменты в Руководстве по качеству, внимательно читал весь текст, сверял учредительные документы с реестром. После чего выдал Акт документальной экспертизы со списком всех косяков, ошибок, неточностей пробелов и прочего что нужно было устранить до выездной экспертизы.
Больше всего затруднений вызвала переделка Руководства по качеству под критерии аккредитации и ЧЕК-ЛИСТ представителя Росаккредитации. Так как на выездной экспертизе по чек-листу требовали найти в тексте РК или в дополнительных инструкциях нужные им пункты (чуть ли не дословно!), показать пальцем, после чего в чек-листе делается отметка – такой-то пункт, такого-то раздела, такая-то станица. Например, показать правила применения изображения знака национальной системы аккредитации, ты должен найти в этот пункт (я открывал электронную версию РК, включал поиск в word-e, вбивал нужный запрос), показать, где он у тебя в тексте находится, где находится ответ на этот пункт. Советую отнестись к этому очень серьёзно, так как спорить с экспертами бесполезно. Чек-лист – это те же самые критерии аккредитации. только в виде таблички, скачать можно внизу страницы. Потом не докажешь, что ты этот пункт описал своими словами в несколько другой форме, но по смыслу подходит. От вас будут требовать чёткой формулировки и чёткого ответа в тексте, лучше сразу записать каждый пункт в своё руководство. Если какие-то пункты вы не делаете по каким-то причинам, например, вы не выполняете работы для сторонних заказчиков, так и надо записать в РК «не работаем со сторонними заказчиками».
Чтобы сильно не перегружать РК текстом или сделать его более гибким, то можно делать отдельные инструкции или стандартные процедуры, а в тексте РК делать ссылки, мол процедура внутреннего аудита описывается в инструкции №123, в чек-листе тогда тоже будет отметка, например, инструкция №123 пункт 3 стр. 2.
На этапе документальной проверки можно вносить изменения в область аккредитации, РК, паспорт и все остальные документы, после выездной проверки менять ничего будет нельзя, только красоту немного навести.
Последний раз редактировалось Tokashi Ср июн 17, 2015 11:37 pm, всего редактировалось 7 раз.
Энергия ядерного взрыва примерно равна 20 Тера кал, что эквивалентно 4 Кило тоннам копчёной колбасы!
![]()
Выездная проверка назначается заранее приказом Росаккредитации. без приказа экспертная компания ничего делать не будет, нам её назначали 3 раза и 3 раза переносили на новый срок, в итоге приехали под самый занавес гос. услуги, когда оставалось 2 дня до конца срока. К приказу прилагается подробная Программа выездной проверки. с указанием необходимых документов для проверки. Их количество опять увеличится, в целом на каждом этапе необходимых документов становится всё больше и больше. Почему сразу не озвучивают всё одним списком не понятно. Выше я уже приводил весь список, что с меня требовали.
У нас было 3 человека, из них 2 эксперта и 1 представитель Росаккредитации (теперь он обязательный участник выездной проверки!). Представителю необходимо обеспечить стол с розеткой для ноутбука и стул, так как он зароется в ваших документах с головой и места ему потребуется много. Почти всю документацию представитель фотографирует на фотоаппарат и заносит её в таком виде в ноутбук, сканеров не признаёт, электронные версии уже готовые не берёт.
Большой проблемой для нас стало требование представителя предоставить ОРИГИНАЛЫ трудовых книжек, учётных карточек персонала, трудовых договоров. Так как лаборатория и отдел кадров у нас находятся на противоположных концах города, то пришлось в срочном порядке гнать машину со всеми оригиналами под конвоем сотрудницы отдела кадров к нам в лабораторию, потом выяснилось что нужно ещё оригинал структуры нашей конторы, оригинал штатного расписания, пришлось гнать машину во второй раз. Тем, у кого лаборатория и административные здания находятся в одном месте, конечно намного проще, если чего-то нет, то можно отвести экспертов туда, где оно есть и показать.
В общем и целом представитель Росаккредитации занималась учредительной документацией и общалась с нашей кадровичкой, периодически меня просили что-то притащить или показать, но основное общение у меня, как у зав.лаба, было с экспертами.
Вначале меня попросили рассказать о лаборатории в общих чертах, когда её создали, зачем, что мы делаем, зачем, какие у нас объекты анализа, чем занимается контора и тд. После чего стали последовательно изучать, как проба проходит все стадии обработки:
1. Как отбирается, кем отбирается, как доставляется в лабораторию, какие документы оформляются при отборе, где описаны все эти процедуры, где всё это регистрируется, записывается, отмечается.
2. После поступления пробы в лабораторию, как она регистрируется, кем регистрируется, как маркируется, в какие журналы, протоколы, базы данных это всё заносится, где описаны все эти процедуры.
3. Как и где написано по каким параметрам анализируется данная проба, как оператору узнать, что ему делать с этой пробой, какие анализы проводить, в каком журнале записывать результаты.
4. Смотрят как оформляются все журналы, прошнурованы ли они, листы посчитаны, кто имеет право записывать в нём, лист с расшифровкой подписей сотрудников, как вносятся исправления, как делается округление, сколько значащих цифр в результате измерения записано, проверяются ли журналы зав.лабом, где отметка о проверке журнала.
5. Как оформляется конечный протокол, соответствует ли форма протокола ГОСТ 17025, достаточно ли много информации в шапке протокола.
По всем этим стадиям запускается шифрованная проба внешнего контроля, которую делают эксперты на основе реальной пробы. В нашем случае мы определяли в питьевой воде центральной системы водоснабжения хлориды двумя методами и железо двумя методами. Пробу регистрировали и она шла в режиме реального времени по всем стадиям, а эксперты наблюдали за процессом. После чего экспертам давался протокол с результатами анализа, они его проверяли и, если их устраивал результат, то они делали протокол внешнего контроля в 2 экземплярах, подписывали его и 1 протокол отдавали нам, второй забирали себе.
У нас отметили косяки:
1. Слишком много значащих цифр в результате анализа
2. Нельзя замазывать корректором ошибки, нужно зачёркивать и подписываться под исправлением
3. Не указано какие сотрудники имеют право вносить записи в журналы, надо делать табличку на лицевой стороне журнала об этом.
4. На последней странице нужно делать табличку с расшифровкой подписей всех сотрудников, кто имеет право вносить туда записи.
5. В журнале регистрации проб необходимо указывать не только дату доставки, но и время доставки.
Последний раз редактировалось Tokashi Пн дек 15, 2014 3:30 pm, всего редактировалось 3 раза.
Энергия ядерного взрыва примерно равна 20 Тера кал, что эквивалентно 4 Кило тоннам копчёной колбасы!
![]()
После этого комиссия пошла по списку всё проверять:
Комиссия направилась изучать наши приборы, стали смотреть, чтобы на каждом приборе была наклеена бирка с данными о нём – название, инвентарный номер, заводской номер, дата последней поверки, дата следующей поверки, наклеена ли голограмма поверителя. Спрашивают, кто на нём работает, что на нём делают, есть ли инструкция по работе на приборе, как происходит анализ, просто интересуются об особенностях работы, как происходит пробоподготовка и т.д. Отвечал на вопросы по большей части я сам, иногда звал на помощь сотрудников, если уж совсем заковыристые вопросы были. Отдельно эксперты интересовались, как происходит техническое обслуживание приборов, настройка, калибровка, поверка. В частности я ответил, что тех обслуживание мы не делаем, если прибор выходит из строя, то вызываем инженера из сервис центра по необходимости. После ремонта делаем отметку в учётной карточке прибора и отправляем на внеочередную поверку.
Отдельно интересовались процедурой приготовления дистиллированной, бидистиллированной, деионизованной воды – как проверяем качество воды, как часто это делаем. Я ответил что контроль осуществляем по ГОСТ 6709-72 один раз в год по всем показателям, а там их не мало и методы контроля просто кошмарные из каменного века, а по удельной электропроводности контролируем 1 раз в месяц. Чем очень удивил экспертов. Сказали, мол надо делать контроль качества для каждой партии воды, то есть каждый раз при включении дистиллятора контролировать качество дист воды по УЭП и жёсткости и делать запись об этом в журнале. К деионазатору претензий не предъявляли, так как у него есть встроенный датчик УЭП и показания выводятся на экран, пока УЭП не достигнет необходимой величины он будет гонять воду через фильтры. Комиссия будет интересоваться вспомогательными приборами, особенно хладо- и термостатами, сушильными шкафами и требовать протоколы аттестации, если вы их используете в для проведения анализа. Смысл здесь заключается в том, что поверку это оборудование не проходит, однако нужно проверять их работоспособность, например, если выделаете БПК, то нужно аттестовать термостат для БПК своими силами или силами метрологической службы вашего предприятия, чтобы убедится в исправности термостата, что он держит необходимую температуру. То же самое с сухим остатком, нужно аттестовывать сушильный шкаф, например.
Проверили все свидетельства о поверке приборов, старые свидетельства лучше убрать с глаз долой, а то не дай бог окажется, что между двух поверок был период, когда старый сертификат истёк, а новый ещё не получили. Комиссия будет ругаться! Все сертификаты должны быть оригинальными, ещё необходимо сделать электронные копии, так как у нас просили их прислать по почте.
Посудой комиссия у нас не интересовалась, хотя до меня доходили слухи, что частенько заставляют избавляться от посуды зарубежных производителей, которую не включили в реестр РФ. Автоматические дозаторы (диспенсоры) и пипетки, полуавтоматические титраторы, так же заставляют поверять, калибровать, аттестовывать вести журналы для этого. Мы от греха подальше их убрали и поставили на столы обычные стеклянные пипетки и бюретки.
Поход на склад химических реактивов или просмотр шкафов для их хранения обязательно будет. В обязательном порядке проверят срок годности реактивов, попросят выборочно предоставить паспорта качества на реактивы. Если найдут просроченный, будут очень сильно ругаться. Спросят осуществляете ли вы переконтроль просроченных реактивов? Если вы это делаете и прямо об этом заявите, то вас ждёт большой геморрой по доказательству всех процедур контроля. Ведь чтобы иметь право осуществлять переконтроль, нужно чтобы как минимум в области аккредитации были заявлены все параметры, по которым вы будете проверять ваши просроченные реактивы. Так как вы аккредитуетесь в первый раз, то такого у вас быть не может по умолчанию. Ну а если хотите этим заняться, то вам в помощь РМГ 59-2003 и ПНД Ф 12.10.1-2000. Проще сказать, что вы используете для работы только свежие реактивы, а просроченные утилизируете в установленном порядке. Об утилизации нас тоже спрашивали. В нашем случае этими вопросами занимается экологический отдел, они же заключают договора с нужными конторами. Об этом стоит упомянуть в РК. Так же комиссия интересовалась порядком хранения прекурсоров, ведением журнала их расхода, наличием металлического сейфа (шкафа) для хранения.
ГСО и стандарт титры
Проверяют сроки годности, требуют паспорта на них, паспорта на ГСО и реактивы должны храниться отдельно в разных папках.
К растворам обычно предъявляют следующие требования:
1) наличие на банке/бутылки этикетки с датой приготовления и сроком годности (например 6 мес) или с датой окончания (годен до 01.01.14), зависит от вкуса эксперта.
2) наличие журнала приготовления растворов, где указано как, кем и когда он был приготовлен, подпись исполнителя. По слухам, некоторых заставляли указывать ещё из какой партии брался реактив, но это скорее всего для фармацевтики важно.
Состояние производственных помещений.
Комиссия осмотрела все помещения, которые имеются, подсобные тоже интересовали и в подвал заглянули. Спросили проводилась ли аттестация рабочих мест по вредным факторам. У нас за это отвечает отдел охраны труда, он и проводил силами подрядной организации.
Проверили имеется ли отдельное помещения для весовой комнаты. Разделены ли помещения по видам работ. Поинтересовались ведём ли мы контроль окружающей среды в лаборатории, по каким параметрам. Ответ – температура и влажность их не устроил, сказали нужно ещё атмосферное давление мерить. На моё замечание, что в большинстве методик химического анализа требуется только 2 фактора мерить, пошли с ними читать методики хим анализа, нашли упоминание о атмосферном давлении только в методике на БПК манометрическим методом. Придётся теперь ещё и атмосферное давление контролировать, соответственно покупать поверенный приборчик для этого. Наличие журнала контроля окружающей среды обязательно. Интересовались, что мы делаем если параметры не соответствуют нормам, имеются ли у нас кондиционеры, вытяжные шкафы, приточная вентиляция.
Ещё интересовались, как осуществляется пропускной режим в здание и в лабораторию, ограничен ли круг лиц имеющий доступ по видам работ, есть ли инструкция где это всё написано. Про доступ к электронной информации, к архиву и к прекурсорам тоже интересовались и инструкции спрашивали.
Офисная техника как и приборы, должны быть в собственности, интересовались лицензиями на ПО, наличие компьютеров, принтеров и выходом в интернет, ограничен ли доступ к компьютерам, программам и базам данных.
Проверяли наличие методик химического анализа, имеется ли синяя печать на ней, ещё в обязательном порядке договор на покупку этих методик что бы был. Видимо, чтобы на прокат эти методики не брали в других лабораториях. Проверяли копии методик, чтобы они были зарегистрированы, учтены, подсчитаны и пронумерованы. Спрашивали как проводится актуализация нормативных документов, есть ли в пользовании электронные базы НД типа Консультатнта плюс. К ГОСТам особых претензий не было, по совету других людей я все скачанные из интернета госты привёл к единому типографскому виду, но комиссия в конце посоветовала использовать копии скачанные из электронных баз типа Консультанта плюс, чтобы там была отметка от куда была скачана эта версия, с датой и временем скачивания.
Проверяли журнал, протоколы и карты Шухарта, выборочно просили показать хроматограммы, электрофореграммы или спектры проделанных анализов для внутрилабораторного контроля из памяти компьютера, проверяли чтобы шифрованная проба для контроля была проведена через все журналы регистрации и результатов анализа, проверяли записи в рабочих журналах персонала. То есть, если вы делали внутрилабораторный контроль только на бумаге, то у вас могут возникнуть большие проблемы с доказательством проделанной работы. Если не знаете как его организовывать, то вам в помощь РМГ 76, ГОСТ 17025-2009. Попросили предоставить акты верификации наших методик анализа, то есть что мы перед тем как внедрили методику анализа в работу сначала проверили её работоспособность. Это проще чем валидация, но тоже сжирает много сил и времени. На мой вопрос зачем её верифицировать, ведь мы покупаем готовую аттестованную, внесённую в реестр методику, был ответ, мол, например, у вас методика БПК разработана для прибора OxiDirect и других схожих по характеристикам приборов, а вы пользуетесь прибором OxiTop. Как вы докажете, что OxiTop делает измерения не хуже OxiDirect? Это нужно проверить и оформить всё в виде протоколов верификации.
Я уже упоминал выше про требования наличия оригиналов трудовых книжек, личных карточек, трудовых договоров, штатного расписания, копий дипломов, оригиналов сертификатов повышения квалификации. Почему по сертификатам повышения квалификации нам сделали замечание, так как у нас были только копии, а оригиналы на руках у сотрудников. По словам комиссии в организации должны хранить оригиналы сертификатов, а если человек увольняется, то их ему должны вернуть. Должен быть ещё договор на повышение квалификации.
Дальше был «смотр крепостных», вызывали каждого работника лаборатории по одному и сверяли человека с его фотографией в личной карточке (мёртвые души не прокатят!). Все сотрудники обязаны работать в лаборатории, как на основном месте работы, никаких совмещений или работе на договорной основе не допускается. Если вы захотите сделать вторую трудовую книжку, то вполне вероятно что об этом может случайно узнать трудовая инспекция, если вдруг эксперт пошлёт выборочный запрос на какого-то работника и гребут потом все. Хотя с другой стороны, когда надо предоставить такую кучу документации из отдела кадров, то ввязываться в такие авантюры нет смысла.
Были недовольны тем, что один человек у нас был на больничном. Но так как по сути он являлся стажёром (опыт работы в области аккредитации менее 3х лет), то стали вводить санкции. Проверяли, как мы оформляем таких стажёров, есть ли отметка в журнале распоряжений о прикреплении стажёра к более опытному товарищу для опеки, что он не имеет права подписи протоколов и тд.
Проверяется тщательно, наличие инструкций на всё что только можно комиссией очень даже приветствуется, любой чих должна быть стандартная процедура. Для каждого прибора должна быть разработана коротка инструкция по работе на нём, чтобы даже солдат-срочник мог прийти и сделать химический анализ на нём. Наличие должностных инструкций, инструкций по ТБ и ПБ, календарных графиков на всё и вся. Попросили показать инструкцию по управлению документацией, полистали её, спросили как организована процедура внесения изменений, как происходит актуализация. Нашу электронную базу данных DControl потестили. Спрашивалик как мы производим хранение информации в электронном виде, как мы делаем резервное хранение информации и защищаем свою информацию от несанкционированного доступа.
Проверяют наличие помещения или, если его нет, то наличие архивных шкафов, как происходит процедура внесения документов в архив и их изъятие. Наличие инструкций на эти виды работ.
Так как у нас водная лаборатория анализа питьевой, природной и сточной воды, то в кодах ОКП, ТН, ВЭД, ТС у нас ставятся прочерки, хотя такие коды существуют. По словам комиссии, если бы мы её продавали, то тогда их нужно было ставить. Слышал, что иногда требуют в области аккредитации сортировать ГОСТы и ПНД Ф по мере возрастания их номера или методики по алфавитному порядку (только не понятно по порядку чего?!). У нас такого требования не было. Размерности писать с верхним регистром, то есть не мг/дм3, а мг/дм и тройку писать в верхний регистр. У методик типа ЦВ нужно писать в обязательном порядке ещё и номер по федеральному реестру ФР, найти их можно здесь: http://www.fundmetrology.ru/ В случае если существует методика только для природной воды, а для питьевой воды такой методики не существует вообще, например для рН, то допускается её использование и для питьевой воды. Например, у ЦИКВа в старой области аккредитации вместо методики на рН в питьевой воде вообще значилось – «паспорт рН-метра», сейчас эту надпись убрали и добавили к природной воде. На сколько это распространено после реформы судить не берусь, нам только польза.
Пример области аккредитации можно скачать здесь.
Честно признаюсь, перед аккредитацией я ждал приезда монстров, которые будут рвать меня на куски и топтать ногами. Такие страхи естественно формируются от незнания. В действительности нас аккредитовывали 3 милые и доброжелательные женщины. Без истерик, без криков, без ругани вполне по-деловому, по-человечески - покажите это, покажите то. Если нашли косяк, то укажут на это, объяснят, как лучше его исправить или, если косяк серьёзный, напишут об этом в предписании, дадут время на исправление. Никто вас за шкирку таскать и тыкать носом не будет. Вот на части могут порвать, так как их трое и каждая хочет проверить свою зону ответственности, то часто не знаешь чью просьбу исполнять первой, нужны младшие помощники на подхвате. В моём случае весь процесс занял 7 часов, в 10 утра начали и в 17 разошлись по домам, с перерывом на обед и ещё на дорожку чая попили.
После проверки составляют список всех косяков, которые можно исправить оперативно, всех документов, которые нужно дослать и всего остального, что нужно экспертам от вас. После исправления и досылки составляется Акт выездной экспертизы. где описывается всё что проверили, что нужно исправить или что соответствовало требованиям. Документик эдак страниц на 10-15, а в конце строчка - лаборатория соответствует требованиям критериев аккредитации. Этот акт необходимо будет подписать в 2х экземплярах у своего генерального директора или заместителя, один экземпляр вернуть экспертам и сделать электронную копию.
Дальше было сказано выждать пару недель и звонить в Москву, узнавать окончательный результат аккредитации и всей государственной услуги в целом. Звонки не очень помогают, долго объясняешь оператору что тебе нужно, потом тебя переключают на другой номер, на котором не берут трубку. Можно ещё посмотреть мониторинг предоставления гос.услуги на сайте Росаккредитации, однако там есть забавный баг – вам предлагают выбрать, когда вы получали услугу до 30 января 2014 года или после. Я как всякий нормальный человек, поначалу нажимал на ссылку «После января 2014 года», так как аккредитовывались мы в сентябре, вписывал номер своего дела, но на мои запросы система выдаёт ответ «НИЧЕГО НЕ НАЙДЕНО». Ради интереса я вернулся и прошёл по ссылке для тех кто аккредитовывался до января 2014 года и система радостно выдала мне всю информацию. Поэтому будьте готовы, что работает система криво и не всегда дружит с логикой.
Через 3 недели Приказ о прохождении аккредитации дошёл по электронной почте самостоятельно, только в приказе ничего не сказано про номер в реестре аккредитованных лабораторий. Выяснять свой номер приходится самостоятельно, нужно выбрать самую первую ссылку «Реестр органов по сертификации и аккредитованных испытательных лабораторий (центров)». потом вбить, например, название вашей конторы и система найдёт нужную запись, где вы сможете выяснить номер своего аттестата аккредитации.
Раньше выдавался сертификат о прохождении аккредитации на бумажном носителе, а теперь лаборатории присваивается виртуальный номер в федеральном реестре аккредитованных лабораторий и гуляй. Мол, можешь всем заинтересованным лицам свой номер сообщать или писать в протоколах, а они пускай сами проверяют по базам данных. Если очень хочется получить сертификат на бумажном носителе, то это отдельная гос. услуга стоимостью 200 р. Пишешь заявление, платишь пошлину и получаешь заветную бумажулю.
Через год надо будет проходить процедуру Проверки компетентности аккредитованной лаборатории, которую нужно будет самим вызывать, и проверит, как прошла работа по исправлению всех косяков, описанных в Акте. Ссылка на топик Проверка компетентности аккредитованной лаборатории 2015
Последний раз редактировалось Tokashi Ср янв 20, 2016 4:44 pm, всего редактировалось 5 раз.
Энергия ядерного взрыва примерно равна 20 Тера кал, что эквивалентно 4 Кило тоннам копчёной колбасы!