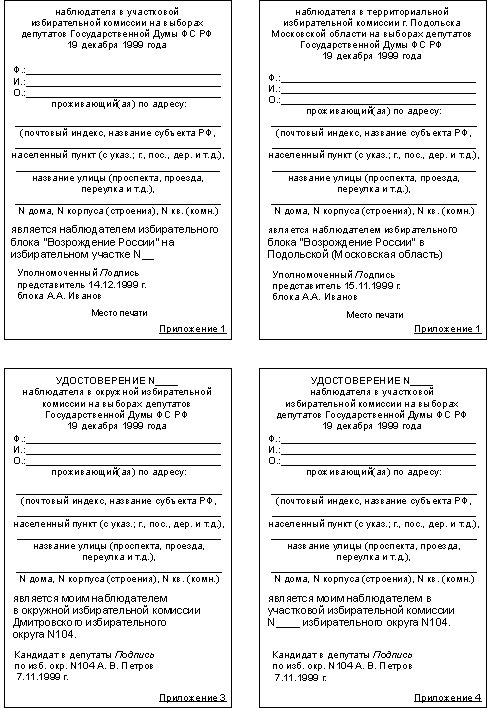







Категория: Бланки/Образцы
В паспорте письменного контроля должны быть указаны: дата изготовления лекарственного препарата, номер рецепта врача или требования медицинской организации (наименование или номер медицинской организации, название отделения), наименования взятых лекарственных средств и их количества, число доз, подписи лиц, изготовившего, расфасовавшего и проверившего лекарственную форму. Паспорт заполняется немедленно после изготовления лекарственной формы, по памяти, на латинском языке, в соответствии с последовательностью технологических операций.
В случае использования полуфабрикатов и концентрированных растворов в паспорте указываются их состав, концентрация, взятый объем или масса.
При изготовлении порошков, суппозиториев указывается общая масса, количество и масса отдельных доз. Общая суппозиторная масса, концентрация и объем (или масса) изотонирующего вещества, добавленного в глазные капли, растворы для инъекций и инфузий, должны быть указаны не только в паспортах, но и на обратной стороне рецепта врача.
Все расчеты должны производиться до изготовления лекарственной формы и записываться на обратной стороне паспорта с указанием формул расчета, использованных коэффициентов.
Если в состав лекарственной формы входят наркотические средства, психотропные, ядовитые и сильнодействующие вещества, а также другие лекарственные средства, подлежащие предметно-количественному учету, их количество указывается на обратной стороне рецепта врача.
Ведение паспортов письменного контроля, если лекарственные формы изготавливаются и отпускаются одним и тем же лицом, также является обязательным. В этом случае паспорта заполняются в процессе изготовления лекарственной формы. Паспорта письменного контроля сохраняются в течение двух месяцев с момента изготовления лекарственных препаратов.
Изготовленные лекарственные препараты, рецепты врача и требования медицинских организаций, заполненные паспорта передаются на проверку провизору, выполняющему контрольные функции при изготовлении и отпуске лекарственных препаратов. Контроль заключается в проверке соответствия записей в паспорте письменного контроля прописи в рецепте врача или требовании медицинской организации, правильности произведенных расчетов.
Если провизором-аналитиком проведен полный химический контроль качества лекарственных препаратов, то на паспорте проставляется номер анализа и подпись провизора-аналитика.
При изготовлении концентрированных растворов, полуфабрикатов и фасовке лекарственных средств все записи производятся в специальных журналах.
Требования к упаковке, маркировки и оформлению лек.
Воды очищенной 10 мл
1.7. Технология лекарственной формы с теоретическим обоснованием.
Одним из требований, предъявляемых к глазным каплям, является их изотоничность.
Не изотонируют глазные капли колларгола из-за того, что натрия хлорид сильный электролит и может вызвать коагуляцию (свертывание, сгущение). Протаргол высыпают тонким слоем на поверхность воды очищенной в широкогорлой подставке (готовят в выпарительной чашке) и оставляют в покое. При этом происходит постепенное набухание частичек протаргола, на границе раздела с водой и растворение.
В асептических условиях в стерильную подставку отмеривают 10 мл воды очищенной и осторожно насыпают на поверхность воды тонким слоем протаргол. Оставляют на 15-20 минут до полного растворения, не взбалтывая во избежание вспенивания, которое затрудняет растворение.
Проводят стерилизующее фильтрование через мембраны 0,22 мкм. Флакон с раствором укупоривают стерильной резиновой пробкой, просматривают его на отсутствие механических включений. При наличии механических загрязнений раствор фильтруют повторно и вновь проверяют на отсутствие механических загрязнений. Флакон укупоривают металлическим колпачком с помощью обжимного устройства. При перевертывании флакона не должно быть подтекания раствора. Флакон обвязывают пергаментной бумагой, оставляя «язычок», на котором делают надпись о наименовании и концентрации раствора.
ППК Лицевая сторона
«А» Дата № рецепта
Aquae purificatae10 ml
1.8. Упаковка и оформление.
Флакон оранжевого стекла оформляют этикеткой розового цвета «Глазные капли», на которой указывают номера аптеки, рецепта, дату и Ф.И.О. больного, способ применения. Наклеивают этикетки «Хранить в прохладном, защищенном от света месте» (приказ МЗ РФ № 120 от 13.11.96.).
1.9. Оценка качества.
- Анализ документации. Имеющийся рецепт, паспорт письменного контроля и номер лекарственной формы соответствуют. Расчеты сделаны верно.
- Правильность упаковки и оформления. Объем флакона соответствует объему лекарственной формы. Оформление соответствует приказу МЗ РФ № 120.
- Цветность. Приготовленные капли бесцветные.
- Механические включения отсутствуют.
- Качество укупорки. При переворачивании флакона раствор не подтекает, что свидетельствует о герметичности упаковки.
81. Возьми: Мази ксероформной 1% 10,0
Дай. Обозначь. Закладывать на ночь за левое веко.
Signa: Закладывать на ночь за левое веко.
1.2. Свойства ингредиентов
Ксероформ (Xeroformium) —Мелкий аморфный порошок желтого цвета со слабым своеобразным запахом, практически нерастворим в воде, 95% спирте, эфире и хлороформе.
Вазелин (Vaselinum) – Однородная гелеобразная масса белого или желтого цвета, плавящаяся при температуре 37-50 С.
Ланолин (Lanolinum) - Густая вязкая масса буро-желтого цвета, слабого своеобразного запаха (температура плавления 36—42 °С).
Масло вазелиновое (Oleum vaselini) - Очищенная фракция нефти, получаемая после отгонки керосина. Бесцветная маслянистая жидкость без запаха и вкуса. Практически нерастворима в воде и спирте. Смешивается с растительными маслами (кроме касторового).
1.3. Ингредиенты совместимы.
1.4. Характеристика лекарственной формы
Гетерогенная система, мазь-суспензия, которая готовится на спецальной основе в качестве которой применяют сплав из 10 частей безводного ланолина и 90 частей вазелина.
1.5. Проверка доз и норм одноразового отпуска
Лекарственная форма для наружного применения. Указанные вещества в рецепте отсутствуют.1.6. Паспорт письменного контроля
Оборотная сторона
Ксероформа:1г-100 гХг-10гХ=(1*10)/100=0,1г
Основы для мазей 10-0,1=9,9
Масла вазелинового 1 кап.
9,9х0,1=0,991.7. Технология лекарственной формы с теоретическим обоснованием
Поскольку ксероформ не растворим ни в воде, ни в вазелине, образуется суспензионная мазь. Количество твердой фазы не превышает 5%, значит, лекарственные вещества тщательно растирают в подогретой ступке с половинным по отношению к препарату количеством вазелинового масла.
В стерильных условиях в выпарительной чашке сплавляют вазелин и ланолин качества «Для глазных мазей». В ступке тщательно растирают ксероформ с вазелиновым маслом и постепенно добавляют мазевую основу. Перемешивают до однородности. Мазь переносят в широкогорлую банку с навинчивающейся крышкой и оформляют к отпуску.
Olei Vaselini 1 gt.
Общая масса 10,0
1.8. Упаковка и оформление
Мазь помещают в стеклянную банку на 10,0 с навинчивающейся крышкой. Наклеивают номер рецепта. Оформляют этикеткой «Наружное», предупредительные надписи: «Хранить в прохладном, защищенном от света месте».
1.9. Оценка качества
Анализ документации. Рецепт выписан правильно. Ингредиенты совместимы. Паспорт письменного контроля и номер соответствуют рецепту.
Правильность упаковки и оформления. Емкость банки соответствует количеству мази. Укупорка правильная. Оформление соответствует приказу МЗ РФ № 120.
Органолептический контроль. Мазь светло-желтого цвета с характерным запахом; однородна.
Масса мази 10,0 ± 0,5, что соответствует нормам допустимых отклонений (± 5%) в общей массе мазей. (Приказ МЗ РФ № 305 от 16.10.97 г.).
85. Возьми: Бензилпеницеллина натриевой соли 200000 ЕД
Раствора магния сульфат 8% 10 мл
Смешай. Дай. Обозначь. По 2 капли 4-6 раз в день в оба глаза.
1.1. Rp. Benzylpenicillini-natrii 200 000 ЕD
Sol. Маgnesiisulftias8% 10ml
M.D.S. По 2 капли 4-6 раз в день в оба глаза.
1.2. Свойства ингредиентов.
Бензилпенициллина натриевая соль (Benzylpenicillini-natrii) – белый мелкокристаллический порошок, без запаха, горького вкуса. Очень легко растворим в воде. Устойчив к действию солнечного света (ГФ Х, ст. 95)
Магния сульфат (Маgnesii sulfas) -. Бесцветные призматические кристаллы, выветривающиеся на воздухе, горько-соленого вкуса, легко растворимы в воде (1:1 в холодной и 3,3:1 в кипящей); практически нерастворимы в спирте (ФСП 42–0006033000).
Вода очищенная (Aqua purificata) - бесцветная прозрачная жидкость без запаха и вкуса (ГФ Х, ст. 73).
1.3. Ингредиенты совместимы
1.4. Характеристика лекарственной формы.
Прописана жидкая лекарственная форма для наружного применения, истинный раствор антибиотика.
1.5. Проверка доз и нормы одноразового отпуска.
Проверка доз в лекарственных формах для наружного применения не проводятся. Примечание 100 000 ЕД соответствуют 0,06 г
1.6. Паспорт письменного контроля.
200000х 0,06 =0,12
Изотонический эквивалент магния сульфата по натрию хлориду 0,14
Изотонический эквивалент бензилпенициллина натриевой соли по натрию хлориду 0,1
Расчет изотоничности 0,8х0,14+0,12х0,15=0,13
Воды очищенной 10 мл
1.7. Технология лекарственной формы с теоретическим обоснованием.
В рецепте прописан раствор антибиотика, требующий асептических условий приготовления лекарственной формы. Раствор является гипертоничным и, соответственно, не требует добавления натрия хлорида.
Готовят 10 мл раствора магния сульфата по общим правилам приготовления стерильных растворов. Стерилизуют при 120 С 8 минут.
В простерилизованном и охлажденном растворе магния сульфата растворяют 0,12 г бензилпенициллина натриевой соли.
В асептических условиях вскрывают склянку с раствором магния сульфата, всыпают туда антибиотик и перемешивают до полного растворения.
Aquae purificatae10 ml
Маgnesii sulftias 0,8
8. Упаковка и оформление.
Флакон оформляют этикеткой розового цвета «Глазные капли», на которой указывают номера аптеки, рецепта, дату и Ф.И.О. больного, способ применения. Наклеивают этикетки «Хранить в прохладном, защищенном от света месте» «Приготовлено асептически» (приказ МЗ РФ № 120 от 13.11.96.).
1.9. Оценка качества.
- Анализ документации. Имеющийся рецепт, паспорт письменного контроля и номер лекарственной формы соответствуют. Ингредиенты совместимы, расчеты сделаны верно.
- Правильность упаковки и оформления. Объем флакона соответствует объему лекарственной формы. Лекарственная форма укупорена плотно. Оформление соответствует приказу МЗ РФ №120.
- Органолептический контроль. Бесцветная прозрачная жидкость, без механических включений.
- Объем лекарственной формы 10,0 ± 1,0 мл, соответствует нормам допустимых отклонений( ±10%) по приказу МЗ РФ 305 от 16.10.97.
86. Возьми: Мази эритромициновой 1% 10,0
Дай. Обозначь. Закладывать за нижнее веко 3-4 раза в день.
Signa: Закладывать за нижнее веко 3-4 раза в день.
1.2. Свойства ингредиентов
Эритромицин (Erythromycinum)— белый порошок, мало растворимый в воде (1—2 мг/мл) и хорошо — в спирте. Гигроскопичный, без запаха, горького вкуса.
Вазелин (Vaselinum) – Однородная гелеобразная масса белого или желтого цвета, плавящаяся при температуре 37-50 С.
Ланолин (Lanolinum) - Густая вязкая масса буро-желтого цвета, слабого своеобразного запаха (температура плавления 36—42 °С).
Масло вазелиновое (Oleum vaselini) - Очищенная фракция нефти, получаемая после отгонки керосина. Бесцветная маслянистая жидкость без запаха и вкуса. Практически нерастворима в воде и спирте. Смешивается с растительными маслами (кроме касторового).
1.3. Ингредиенты совместимы.
1.4. Характеристика лекарственной формы
Гетерогенная система, мазь-суспензия, которая готовится на специальной основе.
Активные вещества: Эритромицин - 10 000 ЕД;
Вспомогательные компоненты: ланолин безводный - 0,4 г, вазелин специальный - до 1 г.
1.5. Проверка доз и норм одноразового отпуска
Лекарственная форма для наружного применения – проверка доз не требуется.
Примечание 1 000 000 ЕД соответствуют 1,110 г
1.6. Паспорт письменного контроля
Оборотная сторона
Эритромицина 0,01Основы для мази 10,0
Вазелинового масла 1 кап1.7. Технология лекарственной формы с теоретическим обоснованием
Рабочее место оборудуется и подготавливается в соответствии с требованиями приказа МЗ РФ № 309 от 21 10.97г. «Об утверждении инструкции по санитарному режиму аптечных организаций».
Мазь готовится в асептических условиях.
Поскольку эритромицин это антибиотик, то готовится суспензионная мазь. Количество твердой фазы не превышает 5%, значит, лекарственные вещества тщательно растирают в подогретой ступке с половинным по отношению к препарату количеством вазелинового масла.
В стерильных условиях в выпарительной чашке сплавляют вазелин и ланолин качества «Для глазных мазей». В ступке тщательно растирают эритромицин с вазелиновым маслом и постепенно добавляют мазевую основу. Перемешивают до однородности.
Olei Vaselini 1 gt.
Общая масса 10,0
1.8. Упаковка и оформление
Мазь помещают в стеклянную банку на 10,0 с навинчивающейся крышкой. Наклеивают номер рецепта. Оформляют этикеткой «Наружное», предупредительные надписи: «Хранить в прохладном, защищенном от света месте».
1.9. Оценка качества
Анализ документации. Рецепт выписан правильно. Ингредиенты совместимы. Паспорт письменного контроля и номер соответствуют рецепту.
Правильность упаковки и оформления. Емкость банки соответствует количеству мази. Укупорка правильная. Оформление соответствует приказу МЗ РФ № 120.
Органолептический контроль. Мазь буровато-желтого цвета; однородна.
Масса мази 10,0 ± 0,5, что соответствует нормам допустимых отклонений (± 5%) в общей массе мазей. (Приказ МЗ РФ № 305 от 16.10.97 г.).
88. Возьми: Стрептомицина сульфата 100000 ЕД
Масла касторового 20,0
Смешай. Дай. Обозначь. Для смазывания ран.
1.1. Rp. Streptomycini sulfatis 100 000 ЕD
M.D.S. Для смазывания ран.
1.2. Свойства ингредиентов.
Стрептомицина сульфат (Streptomycini sulfas) - Стрептомицин - антибиотик, образующийся в процессе жизнедеятельности лучистых грибов Streptomyces globisporus streptomycini или других родственных микроорганизмов. Порошок или пористая масса белого или почти белого цвета, без запаха, горьковатая на вкус; гигроскопичен. Легко растворим в воде, практически нерастворим в спирте, хлороформе и эфире. ФС 42–7651–97.
Масло касторовое (Оlеum Ricini) - Жирное масло, получаемое прессованием и последующей очисткой семян культивируемого растения клещевины (Ricinus communis L.), сем. молочайных (Еuphorbiaсеае). Прозрачная, густая, вязкая, бесцветная или слегка желтоватая жидкость, имеющая слабый запах и своеобразный, неприятный вкус. Смешивается со спиртом, эфиром, хлороформом. ФС 479. ГФ Х изд.
1.3. Ингредиенты совместимы
1.4. Характеристика лекарственной формы.
Мягкая лекарственная форма для наружного применения, представляющая собой линимент-суспензию антибиотика стрептомицина сульфата.
1.5. Проверка доз и нормы одноразового отпуска.
Проверка доз в лекарственных формах для наружного применения не проводятся. Примечание 100 000 ЕД соответствуют 0,12 г
1.6. Паспорт письменного контроля.
Стрептомицина сульфата 0,12
Масла касторового 20,0
1.7. Технология лекарственной формы с теоретическим обоснованием.
В рецепте прописан линимент-суспензия антибиотика, требующий асептических условий приготовления лекарственной формы.
В асептических условиях в стерильный флакон для отпуска на тарирных весах отвешивают 20,0 касторового масла. В ступку отвешивают 0,12 стрептомицина сульфата и растирают с частью касторового масла (примерно ? от массы стрептомицина сульфата согласно правилу Дерягина). Затем частями добавляют оставшееся масло, тщательно перемешивая. Переносят получившуюся суспензию во флакон для отпуска, укупоривают и оформляют к отпуску
Оlеi Ricini 20,0
Streptomycini sulfatis 0,12
8. Упаковка и оформление.
Флакон оформляют этикеткой оранжевого цвета «Наружное», на которой указывают номера аптеки, рецепта, дату и Ф.И.О. больного, способ применения. Наклеивают этикетки «Хранить в прохладном, защищенном от света месте» «Приготовлено асептически» (приказ МЗ РФ № 120 от 13.11.96.).
1.9. Оценка качества.
- Анализ документации. Имеющийся рецепт, паспорт письменного контроля и номер лекарственной формы соответствуют. Ингредиенты совместимы, расчеты сделаны верно.
- Правильность упаковки и оформления. Объем флакона соответствует массе лекарственной формы. Лекарственная форма укупорена плотно. Оформление соответствует приказу МЗ РФ №120.
- Органолептический контроль. Бесцветная прозрачная жидкость, без механических включений.
- Объем лекарственной формы 20,0 ± 0,6, соответствует нормам допустимых отклонений( ±3%) по приказу МЗ РФ 305 от 16.10.97.
95. Возьми: Левомицетина 1,0
Цинка оксида 4,0
Талька поровну 8,0
Смешай, пусть получится порошок.
Выдай. Обозначь: присыпка.
1.2 Свойства ингредиентов.
Левомицетин (Laevomycetinum) - Синтетическое вещество, идентичное природному антибиотику хлорамфениколу, являющемуся продуктом жизнедеятельности микроорганизма Streptomyces venezuelae. Белый или белый со слабым желтовато-зеленым оттенком, кристаллический порошок, горький на вкус. Мало растворим в воде легко - в спирте.
Цинка оксид (Zinci oxydum) - белый или белый с желтоватым оттенком аморфный порошок без запаха. Практически нерастворим в воде и спирте, растворим в растворах щелочей, разведенных минеральных кислотах, а так же в уксусной кислоте (ГФ Х, ст. 736).
Тальк (Talcum) - очень мелкий белый или слегка сероватый порошок без запаха и вкуса.
1.3 Ингредиенты совместимы.
1. 4 Характеристика ЛФ.
Выписана твердая лекарственная форма, представляющая собой сложный недозированный порошок для наружного применения (присыпка) с антибиотиком – левомицетином и легкораспыляющимся веществом – тальком. По дисперсологической классификации – это свободная всесторонне дисперсная система с газообразной дисперсионной средой (воздух) и твердой дисперсной фазой (мелкодспергированные частицы разного размера и формы).
1.5 Проверка доз веществ списков «А» и «Б» и норм одноразового отпуска.
В лекарственных формах для наружного применения поверку доз не проводят. Рецепт выписан правильно, оформлен штампом, печатью лечебно-профилактического учреждения, личной печатью и подписью врача.
1.6 Паспорт письменного контроля
Цинка оксида 4,0
Талька поровну 8,0
Общая масса 1,0+4,0+8,0= 13,0
1.7 Технология ЛФ с теоретическим обоснованием
Подготовку рабочего места проводят в соответствии с приказом МЗ РФ № 309. Порошок готовят в асептических условиях, т.к. в нем содержится левомицетин. Тальк добавляют в последнюю очередь как пылящее вещество.
Для выбора номера ступки рассчитывают общую массу порошков, теоретически удваивая массу «пылящего» вещества: 1,0+4,0+(8,0?2)=21,0. Учитывая полученные данные, выбирают ступку №6, поскольку оптимальная её загрузка близка к рассчитанной массе.
На весах ВР-5 отвешивают 4,0 г цинка оксида и измельчают. Следующим в ступку помещают, отвешенный на весах ВР-1, левомицетин 1, измельчают до получения тонкого, однородного порошка. Затем отвешивают 8,0 талька на весах ВР-10 добавляя его в ступку частями и осторожно перемешивая.
Поскольку этот порошок представляет собой присыпку, то порошок просеивают через шелковое сито № 61 с размером отверстий 0,1 мм. Проверяют на однородность и упаковывают.
Общая масса 13,0
1.8 Упаковка и оформление.
Присыпку упаковывают в баночку с плотно завинчивающейся крышкой. Оформляют этикетками «Наружное», «Беречь от детей».
1.9 Оценка качества
- Анализ документации. Имеющийся рецепт, ППК и номер лекарственной формы соответствуют. Ингредиенты совместимы, расчеты сделаны верно. Паспорт письменного контроля выписан верно.
- Правильность упаковки и оформления. Порошок упакован в баночку с завинчивающейся пробкой. Оформление соответствует приказу МЗ РФ № 120.
- Органолептический контроль. Цвет белый, без запаха и вкуса.
- Однородность порошка. Визуально (при надавливании пестиком на порошковую смесь) не обнаруживается отдельных видимых частиц.
- Отклонения в массе. Общая масса порошка 13,0 +/- 0.39, что соответствует нормам допустимых отклонений (+/-3%) по приказу МЗ РФ № 305.
Государственная фармакопея СССР, изд. X–М. Медицина, 1968.
Государственная фармакопея СССР, изд. XI–М. Медицина, 1987. –
Грецкий В.М. Хоменок В.С. Руководство к практическим занятиям по технологии лекарственных форм-М.:Медицина, 1991.
Муравьев И.А. Технология лекарств: в 2-х Т. – М. Медицина, 1980. – Т.1, 2.
Приказ МЗ РФ № 120 от 05.09.97. «Единые правила оформления лекарств, приготовляемых в аптечных учреждениях (предприятиях) различных форм собственности».
Приказ МЗ РФ № 214 от 16.07.97. «О контроле качества лекарственных средств, изготовляемых в аптеках».
Приказ МЗ РФ № 305 от 16.10.97. «Инструкция по оценке качества лекарственных средств, изготовляемых в аптеках»
Приказ МЗ РФ № 308 от 21.10. 97. «Об утверждении инструкции по изготовлению в аптеках жидких лекарственных форм».
Приказ МЗ РФ № 309 от 21.10.97. «Об утверждении инструкции по санитарному режиму аптечных организаций (аптек)».
Приказ МЗ РФ от 20 декабря 2012 г. N 1175н «Об утверждении порядка назначения и выписывания лекарственных препаратов, а также форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учета и хранения».
Приказ МЗиСР России от23.08.10 г. № 706н «Об утверждении Правил хранения лекарственных средств».
Фармацевтическая технология. Технология лекарственных форм/ под ред. И.И. Краснюка, Г.В. Михайловой. – М. Издательский центр «Академия», 2006. – 590 с.
Практикум по технологии лекарственных форм/ под ред. И.И. Краснюка, Г.В. Михайловой. – М. Издательский центр «Академия», 2006. – 432 с.

В паспорте письменного контроля должны быть указаны: дата изготовления лекарственного препарата, номер рецепта врача или требования медицинской организации (наименование или номер медицинской организации, название отделения), наименования взятых лекарственных средств и их количества, число доз, подписи лиц, изготовившего, расфасовавшего и проверившего лекарственную форму. Паспорт заполняется немедленно после изготовления лекарственной формы, по памяти, на латинском языке, в соответствии с последовательностью технологических операций.
В случае использования полуфабрикатов и концентрированных растворов в паспорте указываются их состав, концентрация, взятый объем или масса.
При изготовлении порошков, суппозиториев указывается общая масса, количество и масса отдельных доз. Общая суппозиторная масса, концентрация и объем (или масса) изотонирующего вещества, добавленного в глазные капли, растворы для инъекций и инфузий, должны быть указаны не только в паспортах, но и на обратной стороне рецепта врача.
Все расчеты должны производиться до изготовления лекарственной формы и записываться на обратной стороне паспорта с указанием формул расчета, использованных коэффициентов.
Если в состав лекарственной формы входят наркотические средства, психотропные, ядовитые и сильнодействующие вещества, а также другие лекарственные средства, подлежащие предметно-количественному учету, их количество указывается на обратной стороне рецепта врача.
Ведение паспортов письменного контроля, если лекарственные формы изготавливаются и отпускаются одним и тем же лицом, также является обязательным. В этом случае паспорта заполняются в процессе изготовления лекарственной формы. Паспорта письменного контроля сохраняются в течение двух месяцев с момента изготовления лекарственных препаратов.
Изготовленные лекарственные препараты, рецепты врача и требования медицинских организаций, заполненные паспорта передаются на проверку провизору, выполняющему контрольные функции при изготовлении и отпуске лекарственных препаратов. Контроль заключается в проверке соответствия записей в паспорте письменного контроля прописи в рецепте врача или требовании медицинской организации, правильности произведенных расчетов.
Если провизором-аналитиком проведен полный химический контроль качества лекарственных препаратов, то на паспорте проставляется номер анализа и подпись провизора-аналитика.
При изготовлении концентрированных растворов, полуфабрикатов и фасовке лекарственных средств все записи производятся в специальных журналах.