





Категория: Инструкции
Лечение хронической крапивницы: миссия – выполнима! (28.09.2016)

Хроническая крапивница - одно из самых непростых состояний, с которыми люди обращаются к врачу аллергологу. Для него характерны зудящиеся волдыри, возникающие едва ли не ежедневно, часто они сливаются друг с другом, образуя отечные зоны, и нередко болезнь длится годами.
В своей практике я часто убеждаюсь в том, что хроническая крапивница (ХК) - изнуряющий недуг, он тяжелым бременем ложится на плечи пациента и врача. Больной ограничен в своей повседневной активности, вынужден соблюдать массу запретов, не высыпается из-за зуда, не может есть любимую еду, заниматься любимым делом, носить одежду, которая нравится, выглядеть так, как мог бы. - этот список можно продолжать до бесконечности.
Для врача сложность проблемы состоит в многофакториальности заболевания. когда различные причины, по крупинкам собираясь. нарушают стабильность в организме его пациента, и коварная крапивница вновь и вновь рецидивирует.
Причин для возникновения крапивницы масса:
Дело в том, что обычно устранение одного какого-либо фактора, вызывавшего волдыри ранее, не дает длительного облегчения, и симптомы продолжают мучить пациента. Оказалось, что сосредоточиваться на поиске причин высыпаний – это путь в тупик.
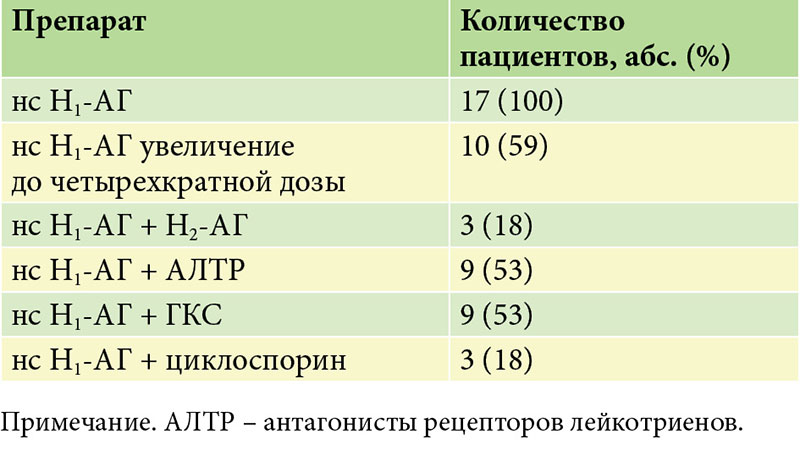
Ученые многих стран активно занимаются проблемой крапивницы, и в последнее время приходят к единому выводу: в 70-80 % случаев хронической крапивницы причина остается неясна, несмотря на долгое, дорогостоящее и объемное обследование. Главным направлением научной мысли в этой связи стал поиск максимально эффективных стратегий для лечения ХК. К сожалению, общепринятое лечение антигистаминными препаратами «четко по расписанию, ежедневно» оказывается неэффективным едва ли не у половины пациентов с ХК. Разочарование толкает страдальца от врача к врачу, из одной лаборатории в другую, но все это не дает желанного результата.
В 2014 году в арсенале российских врачей появился инновационный метод лечения ХК - анти- IgE терапия. Именно этот метод сегодня рассматривают во всем мире как терапию второй ступени ХК: если лечение стандартными (неседативными антигистаминными) препаратами не помогает дольше 4-6 недель, пора обсудить эффективность, безопасность и стоимость анти- IgE препарата - Омализумаб (Ксолар). Препарат уже хорошо известен аллергологам: более 15 лет он применяется в лечении атопической бронхиальной астмы тяжелого течения.
Антитела к IgE на клеточном уровне блокируют каскад реакций. приводящих к развитию крапивницы. Таким образом, мы не просто маскируем симптомы крапивницы, а останавливаем процессы, ее запускающие. На первом этапе лечения Омализумабом (Ксоларом) стандартную терапию – ежедневный прием антигистаминного средства – не прерывают.
Лечение Ксоларом заключается в введении подкожно в плечо 1 раз в 4 недели препарата: симптомы крапивницы угасают в течение первых двух недель, перестают беспокоить человека, после 2-3 введений мы выходим в состояние чистой и спокойной кожи.
Лечение продолжается еще хотя бы 6-9 месяцев (возможно, снижая дозу и удлиняя интервал между введениями антител), отменив регулярный прием антигистаминного средства. Длительность применения Ксолара определяет сама жизнь: столько, сколько понадобится.
В лечении ХК Ксолар разрешен с 12-летнего возраста. На сегодняшний день это единственная надежная и безопасная альтернатива постоянному приему антигистаминных препаратов. при этом со значительно более стойким эффектом и более удобным (редким!) применением.
В Центре лечение ХК данным препаратом применяется с 2015 г. и мы рады видеть, что – с быстрым положительным эффектом! У моего пациента в течение 2-х недель после первого же введения Ксолара симптомы ХК снизились до минимальных высыпаний без зуда не более 2-3-х раз в неделю, не причиняющих никакого  дискомфорта, а к третьему месяцу лечения высыпания прошли полностью. На сегодняшний день терапия длится более года, волдыри не возобновлялись.
дискомфорта, а к третьему месяцу лечения высыпания прошли полностью. На сегодняшний день терапия длится более года, волдыри не возобновлялись.
Анти Ig E терапия препаратом Ксолар на сегодняшний день «палочка-выручалочка» врача аллерголога в лечении столь неприятного и сложного недуга как хроническая крапивница.
Врач аллерголог-иммунолог Меджидова С.Н.
Представляет собой гуманизированное моноклональное IgG1-?-антитело, содержащее человеческую структурную основу с определяющими комплементарность участками мышиного антитела, связывающими иммуноглобулин Е (IgE).
Под влиянием аллергена запускается каскад аллергических реакций, который начинается со связывания IgE с высокоаффинными Fc?R1-рецепторами, расположенными на поверхности тучных клеток и базофилов. Это сопровождается дегрануляцией вышеуказанных клеток и высвобождением гистамина, лейкотриенов, цитокинов и других медиаторов. Данные медиаторы играют непосредственную роль в патофизиологии атопической бронхиальной астмы, в т.ч. в развитии отека дыхательных путей, сокращении гладкой мускулатуры бронхов и нарушении клеточной активности вследствие воспалительного процесса. Они также участвуют в формировании таких симптомов аллергических заболеваний, как бронхоспазм, образование слизи, свистящее дыхание, одышка, ощущение скованности (стеснения) в грудной клетке, заложенность носа, чиханье, зуд, выделения из носа и зуд в носу, зуд в глазах и слезотечение.
Омализумаб, связывается с IgE и предотвращает его взаимодействие с высокоаффинным Fc?R1-рецептором, таким образом происходит снижение количества свободного IgE, который является пусковым фактором для каскада аллергических реакций. При лечении препаратом пациентов с атопической бронхиальной астмой отмечается заметное уменьшение количества Fc?RI-рецепторов на поверхности базофилов. In vitro в базофилах, выделенных у пациентов, получавших лечение Ксоларом, наблюдалось выраженное снижение (приблизительно на 90%) выброса гистамина после стимуляции аллергеном по сравнению с данными, полученными до лечения.
В клинических исследованиях содержание свободного IgE в сыворотке дозозависимо уменьшалось в течение 1 ч после введения первой дозы препарата Ксолар и поддерживалось на достигнутом уровне в периоды между введениями последующих доз. При применении в рекомендуемых дозах среднее уменьшение свободного IgE в сыворотке составляло более 96%. Общий уровень IgE (связанного и несвязанного) в сыворотке крови повышался после первой дозы вследствие образования комплекса омализумаб-IgE, характеризующегося более медленной скоростью выведения по сравнению со свободным IgE. На 16-й нед после введения первой дозы препарата средний уровень общего IgE в сыворотке был в 5 раз выше, по сравнению с таковым до лечения. После отмены препарата Ксолар® обусловленное его действием увеличение общего IgE и уменьшение свободного IgE были обратимыми. После полного выведения препарата из организма не наблюдалось увеличения концентрации IgE в сыворотке крови. Содержание общего IgE оставалось повышенным в течение 1 г после отмены препарата Ксолар®.
При применении препарата Ксолар® у пациентов со среднетяжелой и тяжелой атопической бронхиальной астмой отмечалось достоверное уменьшение частоты обострений бронхиальной астмы (определяемых как ухудшение течения бронхиальной астмы, требующее применения системных ГКС или удвоения исходной дозы ингаляционных ГКС) и снижение потребности в ингаляционных ГКС по сравнению с плацебо.
У больных с бронхиальной астмой и круглогодичным аллергическим ринитом, получавших терапию ГКС, при применении омализумаба в течение 28 нед отмечалось снижение выраженности симптомов бронхиальной астмы и круглогодичного аллергического ринита, а также улучшение параметров легочной функции. Уменьшение частоты обострений бронхиальной астмы и улучшение качества жизни больных (по сертифицированному опроснику качества жизни) на фоне терапии препаратом Ксолар® сохранялось в течение длительного времени по сравнению с плацебо.
При применении препарата Ксолар® у детей от 6 до 12 лет в течение 52 нед было отмечено снижение частоты обострений бронхиальной астмы по сравнению с группой пациентов, получавших плацебо.
В другом исследовании на фоне приема препарата в течение 28 нед у детей в возрасте 6–12 лет было отмечено уменьшение частоты и выраженности обострений бронхиальной астмы, а также снижение дозы применяемых ингаляционных ГКС к концу 28 нед терапии по сравнению с группой плацебо.
ФармакокинетикаФармакокинетика омализумаба изучалась у пациентов с атопической бронхиальной астмой.
Всасывание. После п/к введения абсолютная биодоступность омализумаба составляет в среднем 62%. После однократного п/к введения взрослым и подросткам с бронхиальной астмой всасывание омализумаба происходит медленно, Cmax достигается в среднем через 7–8 дней.
При применении в дозах более 0,5 мг/кг фармакокинетика омализумаба имеет линейный характер. После многократного введения омализумаба AUC в течение периода до 14 сут в равновесном состоянии была в 6 раз выше, чем после введения однократной дозы.
Распределение. In vitro омализумаб с IgE образует комплекс определенного размера. In vitro или in vivo не наблюдалось образования преципитирующих комплексов и комплексов, молекулярная масса которых превышала 1 млн. Да. У пациентов после п/к введения препарата кажущийся VSS составлял (78±32) мл/кг.
В экспериментальных исследованиях не выявлено специфического накопления омализумаба в каких-либо органах и тканях.
Выведение. Cl омализумаба включает как собственно Cl IgG, так и Cl путем специфического связывания и образования комплексов с лигандом-мишенью — свободным IgE сыворотки крови.
Печеночная элиминация IgG включает деградацию в ретикулоэндотелиальной системе печени и эндотелиальных клетках печени. Интактный IgG также выводится с желчью. У пациентов с бронхиальной астмой T1/2 омализумаба из сыворотки составлял в среднем 26 дней, кажущийся Cl в среднем составлял (2,4±1,1) мл/кг/сут.
Кроме того, при увеличении массы тела вдвое отмечалось приблизительно двукратное увеличение кажущегося Cl.
Фармакокинетика в особых клинических случаях
Возраст, расовая\этническая принадлежность, пол. Нет различий в фармакокинетике у пациентов разного возраста (12–76 лет), пола, расовой или этнической принадлежности.
Нарушения функции почек и печени. Фармакокинетические и фармакодинамические параметры омализумаба у пациентов с нарушениями функции почек или печени не установлены.
Использование препарата Ксолар во время беременностиСпециальных исследований по применению омализумаба у беременных женщин не проводилось. В экспериментальных исследованиях не было выявлено прямого или непрямого отрицательного влияния препарата на течение беременности, развитие эмбриона и плода, течение родов и развитие новорожденных. Известно, что молекулы IgG проникают через плацентарный барьер. Применение препарата Ксолар® при беременности возможно только в тех случаях, когда ожидаемая польза для матери превышает потенциальный риск для плода.
Неизвестно, выделяется ли омализумаб с грудным молоком у человека. Человеческий IgG выделяется с грудным молоком. Учитывая возможность выделения препарата с грудным молоком и возможное отрицательное воздействие омализумаба на ребенка, следует соблюдать осторожность при назначении препарата Ксолар® кормящим женщинам.
Противопоказания к применениюПовышенная чувствительность к омализумабу или к любому другому компоненту препарата.
нарушения функции печени и/или почек;
аутоиммунные заболевания или заболевания, связанные с накоплением иммунных комплексов;
повышенный риск развития гельминтных инфекций (особенно на территориях эндемичных по гельминтным заболеваниям) — если лечение гельминтоза неэффективно, рекомендуется временно прекратить терапию;
синдром нарушения всасывания глюкозы-галактозы, непереносимость фруктозы или дефицит сахарозы-изомальтазы — содержание сахарозы в 1 дозе препарата Ксолар® (150 мг) составляет 108 мг.
При применении препарата Ксолар®, как и при использовании любых других протеинсодержащих препаратов, могут возникать местные или системные аллергические реакции, включая анафилактические реакции. Поэтому перед введением препарата необходимо заранее приготовить соответствующее реанимационное оборудование и ЛС, необходимые для купирования реакций гиперчувствительности. Следует проинформировать пациентов о возможности развития анафилактических реакций и обеспечить соответствующее медицинское наблюдение за больными.
Побочные действияНаиболее частыми нежелательными явлениями при применении препарата Ксолар® являются реакции в месте инъекции, включающие боль, отек, эритему и зуд в месте введения препарата, а также головные боли.
Большинство нежелательных явлений были легкой или умеренной степени тяжести. Частота развития нежелательных явлений, возможно связанных с применением препарата, оценивалась следующим образом: очень часто (?1/10), часто (?1/100, <1/10); иногда (?1/1000, <1/100); редко (<1/1000).
Инфекции и инвазии: редко — гельминтные инфекции.
Со стороны иммунной системы: редко — анафилактические реакции и другие аллергические состояния. В клинических исследованиях частота развития всех аллергических реакций в группе пациентов, получавших препарат Ксолар®, и в контрольной группе была сходной.
Со стороны нервной системы: часто — головная боль; иногда — головокружение, сонливость, парестезии, синкопальные состояния.
Со стороны сосудистой системы: иногда — постуральная гипотензия, приливы.
Со стороны дыхательной системы: иногда — фарингит, кашель, аллергический бронхоспазм; редко — отек гортани.
Со стороны ЖКТ: иногда — тошнота, диарея, диспептические явления.
Со стороны кожи и подкожной клетчатки: иногда — крапивница, сыпь, зуд, фотосенсибилизация; редко — ангионевротический отек.
Со стороны организма в целом: иногда — увеличение массы тела, чувство усталости, отечность рук, гриппоподобное состояние.
Местные реакции: часто — реакции в месте инъекции, такие как боль, эритема, зуд, отечность.
В клинических исследованиях у детей 6–12 лет были отмечены следующие нежелательные явления:
Со стороны нервной системы: очень часто — головная боль.
Со стороны ЖКТ: часто — боль в верхнем отделе живота.
Со стороны организма в целом: часто — гипертермия.
Частота развития нежелательных реакций среди пациентов, получавших препарат Ксолар®, и в контрольных группах была сходной.
На фоне терапии препаратом Ксолар® в клинической практике отмечались следующие нежелательные явления (отдельные сообщения):
Со стороны иммунной системы: анафилаксия и анафилактоидные реакции (отмечались как при первом, так и при повторном применениях препарата; в большинстве случаев в течение 2 ч после п/к инъекции, у некоторых больных — спустя более 2 ч после введения препарата Ксолар®).
Со стороны кожи и подкожной клетчатки: алопеция.
Со стороны системы кроветворения: тяжелая идиопатическая тромбоцитопения.
Со стороны дыхательной системы: аллергический гранулематозный ангиит (синдром Чарга-Стросса).
Со стороны костно-мышечной системы: артралгия, миалгия, припухлость суставов.
При применении у детей были отмечены следующие нежелательные явления:
Со стороны нервной системы: очень часто — головная боль.
Со стороны ЖКТ: часто — боль в верхнем отделе живота.
Со стороны организма в целом: часто — гипертермия.
Малигнизация. В клинических исследованиях частота развития злокачественных новообразований в группе пациентов, получавших препарат Ксолар®, и в контрольной группе была различной. В обеих группах — в исследуемой и в контрольной — частота развития злокачественных новообразований оценивалась <1/100 (0,5 и 0,18% для препарата Ксолар® и плацебо соответственно). Учитывая различные типы новообразований, относительно короткий период лечения препаратом, а также клинические особенности каждого из случаев, причинно-следственная связь между применением препарата Ксолар® и развитием злокачественных новообразований маловероятна. Общая частота развития новообразований при применении препарата Ксолар® в клинических исследованиях была сходной с таковой в общей популяции.
В клинических исследованиях у детей 6–12 лет случаев развития злокачественных новообразований в группе пациентов, получавших препарат Ксолар®, зарегистрировано не было.
Гельминтные инфекции. Возможно участие IgE в иммунном ответе при развитей гельминтных инфекций. В плацебо-контролируемых исследованиях у больных с риском развития гельминтных инфекций при применении препарата Ксолар® отмечалась небольшое повышение частоты гельминтозов (однако течение, тяжесть заболевания и ответ на терапию не изменялись). Общая частота гельминтных инфекций во всех клинических исследованиях была менее 1 из 1000 (дизайн исследований не включал специальное изучение частоты гельминтных заболеваний).
Изменение количества тромбоцитов крови. При применении препарата Ксолар® в ходе клинических исследований у нескольких пациентов наблюдалось снижение количества тромбоцитов ниже нормального уровня, что не сопровождалось кровотечением или уменьшением количества гемоглобина. В ходе клинических исследований не было выявлено постоянного уменьшения количества тромбоцитов.
Данные других лабораторных исследований. Значимых изменений лабораторных показателей в ходе клинических исследований не выявлено.
Способ применения и дозыПрепарат вводят только п/к (в/м и в/в вводить нельзя) в область дельтовидной мышцы или переднелатеральную область бедра по 150-375 мг 1 раз в 2-4 нед. Доза зависит от исходной концентрации IgE (МЕ/мл) и массы тела пациента (кг).
ПередозировкаО случаях передозировки до настоящего времени не сообщалось. Максимальная переносимая доза препарата Ксолар® до настоящего времени не определена. При введении пациентам в течение 20 нед наивысшей кумулятивной дозы препарата (44000 мг) не отмечалось развития каких-либо тяжелых острых нежелательных явлений.
Взаимодействие с другими препаратамиПоскольку ферменты цитохрома Р450, механизмы системы энергетического выброса (эффлюксные насосы) и связывания с белками не играют роли в Cl омализумаба, препарат Ксолар® обладает небольшим потенциалом для лекарственного взаимодействия с другими препаратами.
Специальных исследований по взаимодействию препарата Ксолар® с лекарственными препаратами, включая вакцины, не проводилось.
Взаимодействие препарата Ксолар® с лекарственными препаратами, используемыми для лечения бронхиальной астмы, маловероятно. В клинических исследованиях препарат широко применяли в комбинации с ингаляционными и пероральными ГКС, ингаляционными ?-агонистами короткого и длительного действия, производными лейкотриена, теофиллином и пероральными антигистаминными средствами. Вышеуказанные препараты не влияют на безопасность применения препарата Ксолар®.
В настоящее время данные по применению препарата Ксолар® в комбинации со специфической иммунотерапией (гипосенсибилизирующей терапией) ограничены.
Препарат Ксолар® не следует смешивать с какими-либо другими лекарственными препаратами или растворителями кроме воды для инъекций.
Особые указания при приеме препарата КсоларТак же, как при применении всех гуманизированных моноклональных антител — производных рекомбинантной ДНК, в редких случаях возможно образование антител к омализумабу.
Препарат не следует применять для лечения острых приступов бронхиальной астмы, острого бронхоспазма или астматического статуса.
У пациентов с другими аллергическими заболеваниями, кроме бронхиальной астмы, безопасность и эффективность препарата не установлены.
Не изучалось применение препарата Ксолар® у пациентов с синдромом повышенного содержания иммуноглобулина Е, с аллергическим бронхолегочным аспергиллезом, для профилактики анафилактических реакций, при атопическом дерматите, аллергическом рините или при пищевой аллергии.
После начала лечения препаратом Ксолар® не рекомендуется резко отменять системные или ингаляционные ГКС. Дозу применяемых одновременно с препаратом Ксолар® ГКС снижают постепенно под наблюдением врача.
Влияние на способность управлять автотранспортом и работать с механизмами. Пациентам, у которых на фоне применения препарата Ксолар® возникает головокружение, повышенная утомляемость, синкопальные состояния или сонливость следует воздержаться от управления автотранспортом или работы с механизмами.
Условия храненияСписок Б. При температуре 2–8 °C.
Срок годностиПри применении препарата Ксолар в течение первых 16 недель в ходе клинических исследований наблюдалось уменьшение частоты развития обострений БА, снижение числа случаев применения неотложной терапии, а также улучшение симптомов заболевания. Оценку эффективности терапии препаратом Ксолар следует проводить по прошествии минимум 12 недель лечения препаратом.
Препарат Ксолар предназначен для длительной терапии. Отмена препарата, как правило, приводит к восстановлению повышенной концентрации свободного IgEи развитию соответствующих симптомов.
Концентрация общего IgEвозрастает в ходе лечения и остается повышенной в течение одного года после прекращения терапии. Таким образом, концентрация IgEпри повторном определении на фоне терапии препаратом Ксолар не может служить ориентиром для подбора дозы препарата. Для подбора дозы препарата после приостановления лечения на период менее 1 года следует ориентироваться на концентрацию IgEв сыворотке крови, установленную до введения начальной дозы препарата.
Если лечение препаратом Ксолар было приостановлено на 1 год или более для подбора дозы препарата Ксолар следует повторно определить концентрацию IgEв сыворотке крови.
Хроническая идиопатическая крапивница
Рекомендуемая доза препарата Ксолар составляет 300 мг каждые 4 недели в виде п/к инъекции. Лечащему врачу следует периодически повторно оценивать необходимость продолжения терапии препаратом.
Опыт длительного применения омализумаба в клинических исследованиях у пациентов с ХИК ограничен.
Применение у детей и подростков
Препарат Ксолар не рекомендован к применению у пациентов с атопической БА в возрасте до 6 лет и у пациентов с ХИК в возрасте до 12 лет в связи с отсутствием данных по эффективности и безопасности.
Применение у пациентов пожилого возраста
Имеется ограниченный опыт применения препарата Ксолар у пациентов старше 65 лет. Однако данных, свидетельствующих о необходимости коррекции дозы препарата у пациентов этого возраста, нет.
Правила приготовления и введения раствора
При приготовлении раствора для п/к введения препарата Ксолар следуйте приведенным ниже инструкциям.
1. С помощью шприца с иглой 18-го калибра из ампулы набирают 1.4 мл воды для инъекций для приготовления раствора.
2. Установив флакон с препаратом вертикально, его прокалывают иглой в соответствии с правилами асептики и вводят воду для инъекций непосредственно в сухое вещество препарата .
3. Сохраняя флакон в вертикальном положении, для равномерного пропитывания сухого вещества водой для инъекций флакон осторожно вращают (не встряхивая) в течение 1 минуты.
4. Для облегчения растворения флакон вращают в течение 5-10 секунд приблизительно каждые 5 минут, до полного растворения всех твердых частиц. В некоторых случаях для полного растворения сухого вещества может потребоваться более 20 минут. В таком случае повторяют вышеуказанные действия до растворения видимых гелеподобных частиц.
После полного растворения сухого вещества в растворе не должно быть видимых гелеподобных частиц. Допустимо наличие небольших пузырьков или пены по стенкам флакона. Полученный раствор должен быть прозрачным или слегка опалесцирующим, бесцветным или светло-желтоватого цвета. Нельзя использовать раствор при обнаружении в нем инородных частиц.
5. После извлечения иглы переверните флакон на 15 секунд для того чтобы дать возможность раствору перетечь по направлению к пробке. Используя новый шприц объемом 3 см 3. оснащенный иглой 18 калибра с широким просветом, введите иглу в перевернутый флакон. Поместите конец иглы в самую низкую точку раствора, скопившегося в пробке флакона, и наберите раствор в шприц. Перед удалением иглы, вытяните поршень полностью назад до конца цилиндра шприца, чтобы удалить весь раствор из перевернутого флакона.
6. Замените иглу 18 калибра на иглу 25 калибра для п/к введения.
7. Выпустите лишний воздух, крупные пузырьки и избыток раствора, чтобы получить требуемую дозу (объемом 1.2 мл). Тонкий слой небольших пузырьков может оставаться сверху раствора в шприце.
Так как раствор обладает определенной вязкостью, продолжительность инъекции может составить 5-10 секунд.
8. Раствор препарата вводят п/к в область дельтовидной мышцы или в переднелатеральную область бедра, избегая области высыпаний при крапивнице.
Препарат Ксолар не следует смешивать с какими-либо другими лекарственными препаратами или растворами кроме воды для инъекций.
Раствор следует использовать сразу после приготовления, поскольку препарат не содержит антибактериальных консервантов.
В случае необходимости допускается хранение раствора в течение 8 ч при температуре от 2 до 8°С и в течение 4 ч при 30°C.
Неиспользованные остатки препарата и отходы упаковки утилизируют в соответствии с местными требованиями.
Наиболее частыми нежелательными явлениями (НЯ) при применении препарата Ксолар являются головная боль, реакции в месте инъекции, включая боль, отек, эритему и зуд в месте введения препарата. Большинство НЯ были легкой или умеренной степени тяжести. Для определения частоты развития нежелательных реакций, выявленных в ходе клинических исследований, были использованы следующие критерии: очень часто (>1/10), часто (>1/100, <1/10), нечасто (>1/1000, <1/100), редко (<1/1000).
Инфекционные и паразитарные заболевания: нечасто - фарингит; редко - паразитарные инвазии.
Нарушения со стороны иммунной системы: редко - анафилактические реакции и другие аллергические состояния, включая ангионевротический отек, возникновение антител к омализумабу.
Нарушения со стороны нервной системы: часто - головная боль; нечасто - головокружение, сонливость, парестезии, синкопальные состояния.
Нарушения со стороны сосудов: нечасто - постуральная гипотензия, "приливы".
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения: нечасто - кашель, аллергический бронхоспазм; редко - отек гортани.
Нарушения со стороны желудочно-кишечного тракта:нечасто - тошнота, диарея, диспепсические явления.
Нарушения со стороны кожи и подкожных тканей: нечасто - крапивница, сыпь, зуд, фотосенсибилизация; редко - ангионевротический отек.
Общие расстройства и нарушения в месте введения: часто - реакции в месте инъекции, такие как боль, эритема, зуд, отечность; нечасто - увеличение массы тела, чувство усталости, отечность рук, гриппоподобное состояние.
На фоне терапии препаратом Ксолар в пострегистрационном периоде в клинической практике отмечались следующие НЯ, частота которых неизвестна, в связи с тем, что спонтанные сообщения о НЯ поступают в добровольном порядке из популяции неопределенного размера.
Нарушения со стороны иммунной системы: анафилаксия и анафилактоидные реакции (отмечались как при первом, так и при повторном применениях препарата в большинстве случаев в течение 2 часов после п/к инъекции, у некоторых пациентов спустя более 2 часов после введения препарата Ксолар), сывороточная болезнь, может включать повышение температуры тела, лимфаденопатию.
Нарушения со стороны кожи и подкожных тканей: алопеция.
Нарушения со стороны крови и лимфатической системы: тяжелая идиопатическая тромбоцитопения.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения: аллергический гранулематозный васкулит (синдром Чарга-Стросс).
Нарушения со стороны скелетно-мышечной и соединительной ткани: артралгия, миалгия, припухлость суставов.
В клинических исследованиях у детей 6-12 лет были отмечены следующие НЯ:
Нарушения со стороны нервной системы: очень часто - головная боль.
Нарушения со стороны желудочно-кишечного тракта: часто - боль в верхнем отделе живота.
Общие расстройства и нарушения в месте введения: очень часто - повышение температуры тела.
Наиболее частыми НЯ при применении препарата Ксолар у пациентов 12 лет и старше являются головная боль и назофарингит.
Представленные ниже НЯ отмечались у >1% пациентов во всех группах лечения и не менее чем на 2% чаще у пациентов, получавших препарат Ксолар в рекомендованных дозах (150 мг и 300 мг), по сравнению с группой применения плацебо.
НЯ сгруппированы в соответствии с классификацией органов и систем органов MedDRA, в пределах каждой группы перечислены в порядке уменьшения частоты встречаемости. Для определения частоты встречаемости использованы следующие критерии: очень часто (>1/10), часто (>1/100, <1/10), нечасто (>1/1000, <1/100), редко (<1/1000), очень редко (<1/10000).
Инфекционные и паразитарные заболевания: часто - назофарингит, синусит, инфекции верхних дыхательных путей, включая вирусной этиологии, инфекции мочевыводящих путей.
Нарушения со стороны нервной системы: очень часто - головная боль; часто - головная боль в области придаточных пазух носа.
Нарушения со стороны скелетно-мышечной и соединительной ткани: часто - артралгия, миалгия, боль в конечностях, костно-мышечная боль.
Общие расстройства и нарушения в месте введения: часто - повышение температуры тела, реакции в месте инъекции, такие как отечность, эритема, боль, гематома, зуд, кровотечение, крапивница.
Анафилаксия. В пострегистрационном периоде частота встречаемости анафилактических реакций при применении препарата Ксолар составила приблизительно 0.2% (из всех случаев анафилактических реакций на 500000 пациенто-лет).
Анафилактические реакции в анамнезе, не связанные с применением омализумаба, могут являться фактором риска развития анафилактической реакции на введение препарата Ксолар.
Малигнизация. Общая частота развития новообразований при применении препарата Ксолар в клинических исследованиях была сходной с таковой в общей популяции. Частота развития злокачественных новообразований в группе пациентов, получавших препарат Ксолар, и в контрольной группе оценивалась <1/100. В наблюдательном исследовании при сравнении пациентов, получавших лечение препаратом Ксолар, и пациентов, получавших иное лечение продолжительностью до 5 лет, не было выявлено увеличения риска развития злокачественных новообразований. У детей 6-12 лет случаев развития злокачественных новообразований в группе пациентов, получавших Ксолар, зарегистрировано не было.
Тромбоэмболические осложнения. В контролируемых клинических исследованиях у пациентов, получавших лечение препаратом Ксолар, отмечалось развитие тромбоэмболических осложнений, включая инсульт, транзиторные ишемические атаки, инфаркт миокарда, нестабильную стенокардию, смерть от сердечно-сосудистых причин (в т.ч. летальный исход по неустановленным причинам). При анализе основных факторов сердечно-сосудистого риска, соотношение рисков составило 1.32.
Гельминтные инвазии. Возможно участие IgEв иммунном ответе при развитии гельминтных инвазий. В плацебо- контролируемых исследованиях у пациентов с аллергическими заболеваниями и риском развития гельминтных инвазий при применении препарата Ксолар отмечалась небольшое повышение частоты возникновения гельминтозов (однако течение, тяжесть заболевания и ответ на терапию не изменялись). Общая частота развития гельминтных инвазий во всех клинических исследованиях была менее 1 из 1000 (дизайн исследований не включал специальное изучение частоты развития гельминтных заболеваний).
Изменение количества тромбоцитов крови. При применении препарата Ксолар в ходе клинических исследований у нескольких пациентов наблюдалось снижение количества тромбоцитов ниже нормы, что не сопровождалось кровотечением или уменьшением концентрации гемоглобина. В ходе клинических исследований не было выявлено постоянного уменьшения количества тромбоцитов.
Данные других лабораторных исследований. Значимых изменений лабораторных показателей в ходе клинических исследований не выявлено.
Противопоказания к применению
— повышенная чувствительность омализумабу или к другому компоненту препарата;
— детский возраст до 6 лет у пациентов с атопической БА и до 12 лет у пациентов с ХИК в связи с отсутствием соответствующих данных по эффективности и безопасности.
С осторожностью. следует с осторожностью применять препарат у пациентов с нарушениями функции печени и/или почек, с аутоиммунными заболеваниями или заболеваниями, связанными с накоплением иммунных комплексов.
При применении препарата Ксолар, как и при применении любых других протеинсодержащих препаратов, могут возникать местные или системные аллергические реакции, включая анафилактические реакции. Перед введением препарата Ксолар необходимо заранее приготовить соответствующее реанимационное оборудование и лекарственные средства, необходимые для купирования реакций гиперчувствительности. Необходимо с осторожностью применять препарат у пациентов с повышенным риском развития гельминтных инвазий (особенно в эндемичных районах).
Применение при беременности и кормлении грудью
Специальных исследований по применению омализумаба у беременных женщин не проводилось. В экспериментальных исследованиях не было выявлено прямого или непрямого отрицательного влияния препарата на течение беременности, развитие эмбриона и плода, течение родов и развитие новорожденных. Известно, что молекулы IgG проникают через гематоплацентарный барьер. Применение препарата во время беременности возможно только в случае, если польза для матери превышает потенциальный риск для плода.
Человеческий IgG выделяется с грудным молоком. Неизвестно, выделяется ли омализумаб с грудным молоком у человека. Нельзя исключить риск для новорожденных/младенцев, находящихся на грудном вскармливании, поэтому омализумаб не следует применять в период грудного вскармливания. В случае необходимости применения препарата грудное вскармливание следует прекратить.
Влияние на фертильность
Отсутствуют данные о влиянии омализумаба на фертильность у человека. Исследования продемонстрировали отсутствие нарушения мужской и женской фертильности у животных при применении многократных доз, превышающих 75 мг/кг.
Применение при нарушениях функции печени
Следует с осторожностью применять Ксолар у больных с нарушениями функции печени.